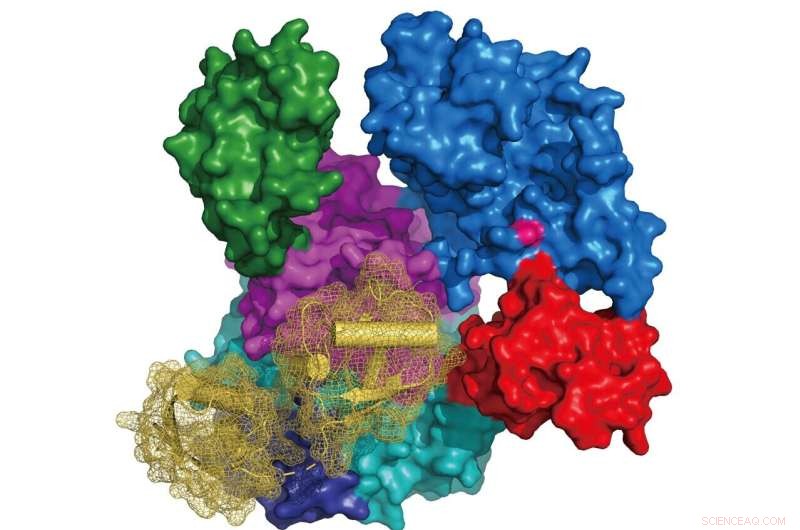
Image :Structure de UBA6 (représentation de surface colorée selon son architecture de domaine, site actif cystéine en rose) en complexe avec FAT10 (diagramme ruban en jaune avec représentation de surface en maillage). Crédit :Groupe Schindelin
Des chercheurs du Centre Rudolf Virchow de l'Université de Würzburg ont dévoilé les structures cristallines d'UBA6 en complexe avec l'ATP ou la protéine de type ubiquitine FAT10. Ces résultats fournissent la base pour étudier les rôles individuels d'UBA6 dans la fixation de l'ubiquitine ou de FAT10 aux protéines cibles et aux voies cellulaires en aval avec des implications possibles pour l'étiologie de certaines tumeurs. Cette étude a été publiée dans la revue Nature Communications .
L'ubiquitylation des protéines cibles est l'une des modifications post-traductionnelles les plus importantes et joue un rôle essentiel dans de nombreux processus cellulaires. L'ubiquitylation est réalisée par une cascade enzymatique séquentielle d'enzymes d'activation E1, d'enzymes de conjugaison E2 et d'enzymes de ligature E3. Pendant de nombreuses années, UBA1 a été considérée comme la seule enzyme E1 qui active l'ubiquitine, jusqu'à ce qu'en 2007 une deuxième enzyme activatrice d'ubiquitine soit découverte :UBA6.
Une cible potentielle pour le développement de médicaments
UBA6 n'est présent que chez les vertébrés et les oursins. Curieusement, UBA6 est une enzyme E1 inhabituelle car elle active à la fois l'ubiquitine et la protéine de type ubiquitine (Ubl) FAT10. En raison de sa gamme restreinte d'événements d'ubiquitylation, par rapport à l'action de l'enzyme générique d'activation de l'ubiquitine UBA1, et étant la seule fixation FAT10 catalysant E1, UBA6 est considérée comme une cible médicamenteuse potentielle. Pour explorer davantage l'inhibition ciblée d'UAB6, il est essentiel de comprendre sa double spécificité et d'identifier les variantes de l'enzyme qui sont altérées dans l'activation de l'ubiquitine ou de FAT10.
Le groupe de recherche du professeur Hermann Schindelin du Centre Rudolf Virchow de l'Université de Würzburg rapporte les premières structures d'UBA6, en complexe avec l'ATP ou le FAT10. Fait intéressant, leurs études structurelles et de modélisation ont également révélé comment UBA6 permet la double reconnaissance de l'ubiquitine et de FAT10. Une autre découverte clé est l'identification de variants UBA6 qui abolissent sélectivement l'activation de l'ubiquitine ou de FAT10. "Ces résultats fournissent la base pour étudier les rôles individuels que joue UBA6 dans l'activation de l'ubiquitine ou de FAT10 dans les voies cellulaires en aval", déclare Schindelin.
Empêtré dans diverses maladies
Étant donné que l'ubiquitylation et la FAT10ylation sont impliquées dans de multiples processus cellulaires, il n'est pas surprenant que des dysfonctionnements dans un ou plusieurs composants de ce système conduisent à une variété de maladies. Il a été rapporté que la dégradation du protéasome médiée par UBA6 était impliquée dans les états physiologiques et physiopathologiques associés au cerveau chez la souris. Fait intéressant, UBA6 s'est avéré surexprimé dans le cerveau humain de patients atteints de la maladie d'Alzheimer. La protéine suppresseur de tumeur p53 est un substrat FAT10 et une régulation double négative de FAT10 et p53 s'est avérée critique dans le contrôle de la tumorigenèse, ce qui est conforme à la surexpression de FAT10 dans de nombreux types de cellules cancéreuses.
Alors que les prédictions concernant l'orientation de l'ubiquitine dans le complexe avec UBA6 pouvaient être facilement générées sur la base de la structure du complexe UBA6-ATP et des structures UBA1-Ub disponibles, il semblait impossible de prédire comment FAT10 et, en particulier, son domaine N-terminal ( NTD) interagirait avec UBA6. Par conséquent, la détermination de la structure co-cristalline UBA6-FAT10 était une étape cruciale. Sur la base des structures dérivées expérimentalement et du complexe modèle UBA6-ubiquitine, un commutateur de sélectivité a été identifié, ce qui a conduit à la découverte ultérieure de variants UBA6 abolissant sélectivement l'activation de l'un ou l'autre des modificateurs.
De futures études sur UBA6 avec les mutants sélectivement altérés sont nécessaires pour étudier les liens possibles entre l'ubiquitylation catalysée par UBA6 et la FAT10ylation dans le contexte du cancer. "Si des relations causales peuvent être établies, l'inhibition ciblée d'UBA6 par des approches de dépistage enzymatiques et in silico sera menée", explique Schindelin. "Avec l'ensemble de mutans qui altèrent sélectivement l'ubiquitylation ou la FAT10ylation, nous étudierons l'altération sélective de l'un ou l'autre processus dans des expériences cellulaires avec un accent particulier sur les cellules cancéreuses." L'équipe analyse avec succès la structure de la protéine FAT10 en vue d'un traitement potentiel contre le cancer