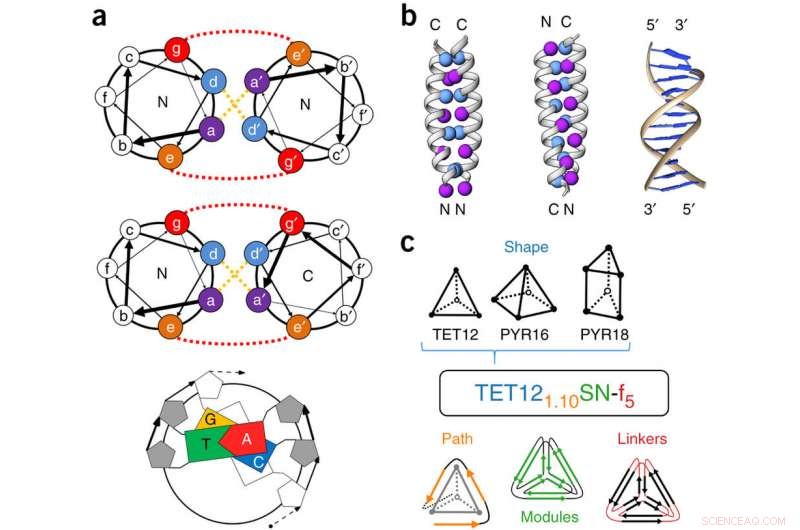
Structure du module CC et nomenclature CCPO. (a) Les bobines enroulées (CC) sont définies par une unité répétitive régulière de sept résidus d'acides aminés, étiqueté un, b, c, ré, e, F, ou g (une répétition heptadique). La spécificité d'interaction est codée par des interactions hydrophobes aux positions a et d (lignes pointillées jaunes) et des interactions électrostatiques entre les positions e et g (lignes pointillées rouges). Les règles de complémentarité de l'ADN sont relativement simples, puisque seuls quatre éléments de construction sont présents. (b) Les dimères CC peuvent s'apparier dans une orientation parallèle ou antiparallèle. Les positions a et d sont représentées par des sphères. L'ADN brin B ne peut s'apparier que dans une orientation antiparallèle. (c) Un exemple de nom (TET12
(Phys.org)—Une grande équipe de chercheurs avec des membres de Slovénie, la Grande-Bretagne, Serbie, La France et l'Espagne ont développé une technique qui permet aux protéines de s'auto-assembler en formes géométriques à la demande. Dans leur article publié dans la revue Biotechnologie naturelle, le groupe décrit leur technique et les utilisations possibles des minuscules cages.
Dans les années récentes, les scientifiques ont manipulé des brins d'ADN pour les amener à se lier en des formes utiles (origami d'ADN). Dans ce nouvel effort, les chercheurs ont fait quelque chose de similaire en utilisant des protéines à la place. Les personnes sur le terrain pensent que de tels objets pourraient être utiles pour des applications telles que la construction de paquets pour administrer des médicaments à des endroits ciblés du corps humain.
Pour provoquer l'auto-assemblage des protéines, les chercheurs ont tordu des brins doubles de sections d'acides aminés (bobines enroulées) en brins d'acides aminés qui ont été placés dans des sections coupées de brins de protéines naturelles. Les chercheurs décrivent les bobines enroulées comme ressemblant à des segments de fil. Les sections qui ont été introduites dans la chaîne ont été choisies spécifiquement parce que des tests antérieurs ont montré qu'elles fléchissent de la manière souhaitée lorsqu'elles sont exposées à des facteurs tels que l'électricité ou l'eau. Le résultat était un seul brin avec des coudes qui faisaient que le brin global prenait la forme d'un objet géométrique. L'équipe rapporte qu'ils ont pu créer des tétraèdres, pyramides à quatre côtés et prismes triangulaires. Les tests des structures ont montré qu'elles étaient solubles dans les solutions aqueuses et qu'elles pouvaient prendre leurs formes à la fois à l'intérieur et à l'extérieur des cellules. L'équipe a également montré que les structures pouvaient être formées et éventuellement utilisées chez des souris vivantes.
Les chercheurs notent que des paramètres tels que la charge des bobines enroulées et le capuchon qui se forme à leurs extrémités peuvent être ajustés pour créer différentes formes et pour dicter les conditions dans lesquelles les protéines s'auto-assemblent. Ils rapportent en outre qu'il était possible de créer une boîte à outils de blocs de construction des structures, permettant une plus grande, des structures plus complexes à partir des formes de base. Ils suggèrent que de telles constructions pourraient être utilisées pour transporter des médicaments ou des vaccins à travers le corps ou pour créer d'autres structures qui incorporent une fonctionnalité d'acides aminés.
© 2017 Phys.org