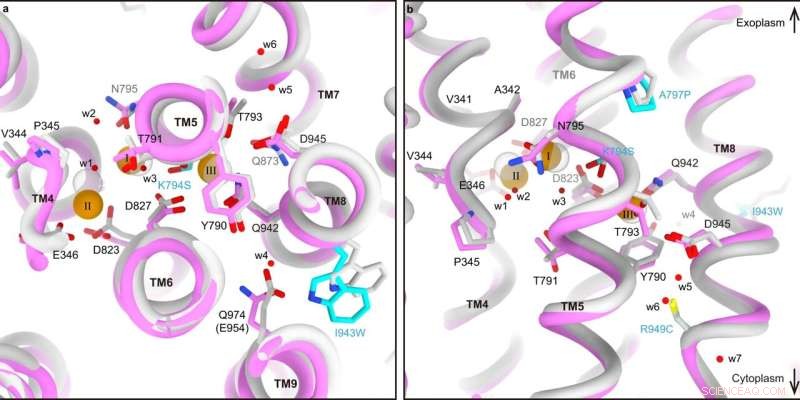
Comparaison du site de liaison cationique entre SPWC-ngHKA et NKA. a, b Sites de liaison cationique superposés de SPWC-ngHKA dans le 3Na + ·État E1-ATP (tubes et bâtonnets roses) et le (3Na + )État E1P-ADP de NKA (gris clair, 3wgu) vu du côté cytoplasmique (a), ou parallèle à la membrane avec le côté extracellulaire vers le haut (b). Les résidus mutés sont indiqués par des carbones cyan. Les trois Na + les ions (orange) et sept molécules d'eau (w1–w7, rouge) identifiés dans la carte cryo-EM de SPWC-ngHKA sont représentés par des sphères. Tous les modèles sont alignés par leur région TM7-10 immobile. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-32793-0
Dans un article de recherche récemment publié, Pablo Artigas, Ph.D., du Center for Membrane Protein Research du Texas Tech University Health Sciences Center (TTUHSC) School of Medicine's Department of Cell Physiology and Molecular Biophysics, et une équipe de collaborateurs ont appliqué analyses fonctionnelles et structurelles pour étudier quelles caractéristiques structurelles du proton/potassium (H + /K + ) pompes et sodium/potassium (Na + /K + ) les amènent à réguler le passage des sels à travers les barrières membranaires.
L'étude "Structure et fonction de H + /K + Les mutants de la pompe révèlent Na + /K + Pump Mechanisms", a été publié en septembre par Nature Communications . L'équipe de recherche comprenait des étudiants diplômés d'Artigas et du TTUHSC, Victoria C. Young, Ph.D., et Dylan J. Meyer, Ph.D.; Hanayo Nakanishi, Ph.D., Atsunori Oshima, Ph.D., et Kazuhiro Abe, Ph.D., de l'Université de Nagoya (Japon) ; et Tomohiro Nishizawa, Ph.D., de la Yokohama (Japon) City University.
Dans chaque cellule humaine, le Na + /K + la pompe transporte deux potassium (K + ) dans la cellule et fait ressortir trois ions sodium (Na + ) ions. Les gradients de concentration de ces ions sont nécessaires pour la signalisation électrique dans le cerveau, le cœur et les muscles, ainsi que pour l'apport de nutriments et la régulation des concentrations intracellulaires de calcium et de protons dans tous les types de cellules. Les quatre types de Na + /K + les pompes se localisent dans différents tissus. Mutations de la maladie dans trois de ces Na + /K + les pompes provoquent des troubles neuromusculaires, cognitifs, endocriniens ou cardiovasculaires.
Deux H + /K + les pompes ont des sites de reconnaissance d'ions légèrement différents et sont exprimées du côté apical de nombreux épithéliums, où elles transportent un proton (H + ) hors de la cellule et faire entrer un potassium (K + ) ion. Le H + gastrique /K + pompe acidifie l'estomac et est la cible de l'oméprazole, un antiacide. Le H + non gastrique /K + la pompe participe à K + réabsorption et contribue à l'acidification des voies respiratoires, une partie importante de la pathologie de la mucoviscidose.
"Les deux protéines (H + /K + et Na + /K + pompes) sont identiques à environ 70 %, nous avons donc examiné quelles différences mineures pourraient être responsables de la différence de sélectivité et du nombre d'ions transportés", a expliqué Artigas.
L'étude a déterminé que le remplacement simultané des résidus d'acides aminés à quatre endroits dans le H + non gastrique /K + pompe avec ceux présents dans le Na + /K + pompe est suffisante pour transformer une protéine qui transporte normalement un proton pour un potassium en une protéine qui transporte trois sodium pour deux potassium, donnant un nouvel aperçu de la façon dont ces protéines sélectionnent les ions qu'elles doivent transporter.
« À notre connaissance, il s'agit de la première démonstration de la modification d'une protéine qui transporte exclusivement H + se transforme en une protéine qui transporte exclusivement Na + ", a déclaré Artigas. "Nous pensons que cela pourrait aider d'autres personnes menant des travaux similaires avec d'autres protéines membranaires pour concevoir un changement similaire de la sélectivité entre Na + et H + . Nous pouvons le faire dans un sens, mais nous essayons maintenant de le faire dans l'autre sens :venir du Na + /K + pompe vers le H (non gastrique) + /K + pompe."
L'importance des H + non gastriques /K + pompe dans le corps reste largement inconnue, mais on sait que son inhibition prévient les infections des voies respiratoires dans un modèle animal de mucoviscidose.
"En plus de transformer un type de protéine en un autre, grâce à nos collaborateurs structuralo-biologistes au Japon, nous avons déterminé la structure du H + non gastrique /K + pompe", a déclaré Artigas. "Cette structure pourrait être utilisée pour développer des inhibiteurs spécifiques pour traiter efficacement les patients atteints de mucoviscidose."
Maintenant qu'Artigas et ses collaborateurs ont réussi à convertir le H + non gastrique /K + pompe à Na + /K + pompe, ils tentent plusieurs autres conversions en utilisant l'H + gastrique /K + et Na + /K + pompes.
"Nous n'avons toujours pas réussi à convertir le H + gastrique /K + pomper dans un Na + /K + pompe ou un Na + /K + pomper dans un H + /K + pompe pour bien comprendre le mécanisme de la sélectivité », a déclaré Artigas. « Nous utiliserons les structures actuelles et futures du H + non gastrique /K + pompe pour tenter de générer des inhibiteurs spécifiques pour aider à traiter les patients atteints de mucoviscidose." + Explorer davantage