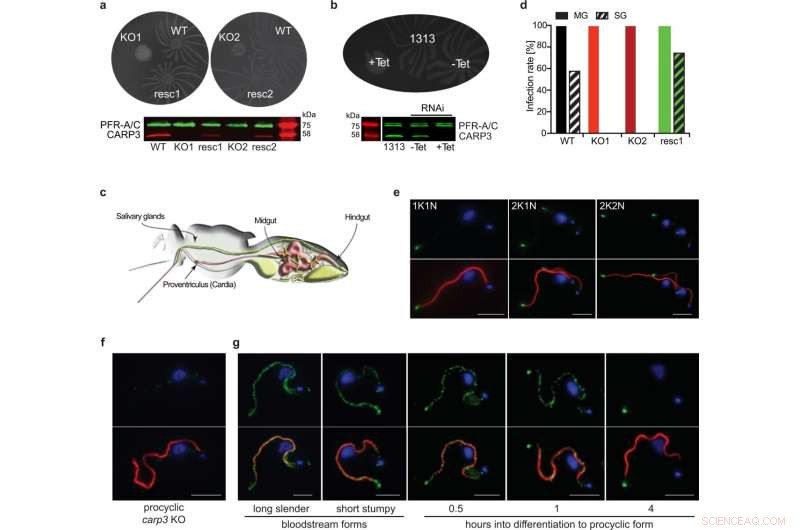
CARP3 est un régulateur flagellaire de la motilité sociale (SoMo) et est essentiel pour la colonisation des glandes salivaires de la mouche tsé-tsé. a Essais SoMo de T. brucei procyclique AnTat 1.1 de type sauvage (WT), carp3 knock-out (KO, clones indépendants KO1, KO2) ou sauvetage CARP3 in situ (resc, clones indépendants resc1, resc2). Le Western blot a été sondé avec anti-CARP3 et anti-PFR-A/C (témoin de charge). b Dosage SoMo sur ARNi inductible par la tétracycline (Tet) de CARP3 (-Tet / +Tet 24 h) et la lignée cellulaire parentale AnTat 1.1 1313. Le Western blot montre la répression de CARP3 détectée par des anticorps comme en (a). c Illustration du système digestif et des glandes salivaires d'une mouche tsé-tsé (adapté de91). d Taux d'infection de l'intestin moyen (MG) ou des glandes salivaires (SG) de la mouche tsé-tsé avec des lignées cellulaires T. brucei AnTat 1.1 comme dans (a). Les mouches ont été disséquées 34-36 jours p.i., n (mouches) =48 (WT), 50 (KO1), 50 (KO2), 40 (resc1). 10 mM de L-glutathion ont été inclus dans le repas de sang (colonie de mouches tsé-tsé de l'Institut de médecine tropicale d'Anvers). Analyse par immunofluorescence indirecte de CARP3 (vert) dans T. brucei AnTat 1.1 forme procyclique WT (e) ou carp3 KO (f). Les panneaux supérieurs montrent CARP3 (vert) et l'ADN nucléaire et mitochondrial coloré avec DAPI (bleu), les panneaux inférieurs montrent une superposition avec l'axonème (rouge; coloré avec l'anticorps mAB25). En (e), des cellules à différents stades du cycle cellulaire sont représentées (1K1N, 2K1N, 2K2N ; K kinétoplaste, N noyau). g Analyse par immunofluorescence indirecte de CARP3 (vert) comme dans (e, f) lors de la différenciation de la culture de la circulation sanguine aux formes procycliques. Barre d'échelle en (e–g) 5 µm. Les données source de (a, b) et (d) sont fournies sous forme de fichier de données source. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-33108-z
Les chercheurs du LMU ont déchiffré un mécanisme de signalisation crucial qui permet aux trypanosomes d'atteindre les glandes salivaires des mouches.
Les mouches tsé-tsé sont courantes dans une grande partie de l'Afrique. Ils se nourrissent du sang des humains et d'autres animaux. Au cours de ce processus, ils peuvent transmettre des trypanosomes, un protozoaire parasite. Trypanosoma brucei provoque la maladie du sommeil chez les humains. Les agents pathogènes s'infiltrent dans l'hôte par la salive des mouches tsé-tsé infectées :à partir du sang, ils atteignent le cerveau, entraînant des symptômes mortels s'ils ne sont pas traités.
Mais comment les trypanosomes pénètrent-ils dans les glandes salivaires des glossines après leur repas de sang ? Le Dr Sabine Bachmaier et le professeur Michael Boshart de la division de génétique de la faculté de biologie du LMU, ainsi que des collègues scientifiques, ont trouvé une réponse surprenante à cette question.
Ils montrent qu'un appareil de signalisation à l'extrémité flagellaire des protozoaires contrôle la migration des trypanosomes dans la mouche tsé-tsé via le messager connu sous le nom d'adénosine monophosphate cyclique (cAMP). L'élimination d'un composant du complexe enzymatique qui produit la molécule de signalisation de l'AMPc était suffisante pour prévenir l'infection des mouches. Les résultats de l'étude ont maintenant été publiés dans Nature Communications .
Un aperçu du réseau réglementaire
À titre d'information :Les bovins et les antilopes sont des réservoirs naturels de Trypanosoma brucei. Lors d'un repas de sang, des agents pathogènes pénètrent dans le tractus gastro-intestinal des mouches tsé-tsé. Afin de survivre et de se propager davantage, les trypanosomes doivent s'adapter à leur environnement changeant. Ils migrent dans les deux sens entre la circulation sanguine et les tissus d'un hôte mammifère et entre le tube digestif et les glandes salivaires d'une mouche tsé-tsé, au cours desquelles ils traversent une série de stades de développement.
"Notre projet est basé sur plusieurs collaborations internationales avec des groupes de recherche à Paris, Anvers et Rio de Janeiro", explique Bachmaier. "Nous nous intéressons depuis longtemps à la question de savoir comment les parasites parviennent à s'orienter dans la mouche tsé-tsé et comment cela pourrait être évité afin de contrôler la transmission de la maladie."
Il y a environ dix ans, le groupe de recherche a identifié un nouveau composant de la voie de signalisation de l'AMPc, spécifique aux trypanosomes, la protéine de réponse à l'AMP cyclique 3 (CARP3). "Notre découverte que CARP3 se trouve principalement à l'extrémité des flagelles des trypanosomes nous a mis sur la piste d'un appareil de signalisation spécialisé pour l'orientation des parasites chez la mouche tsé-tsé", explique Bachmaier.
Lorsque les chercheurs ont retiré le gène CARP3 par génie génétique, la composition des enzymes (adénylate cyclases) qui produisent l'AMPc à l'extrémité du flagelle a également changé. "Les trypanosomes n'étaient plus capables par la suite de coloniser efficacement les glossines", explique le scientifique. "Dans les glandes salivaires, nous n'avons plus trouvé une seule cellule de parasites."
De la recherche fondamentale à l'application :L'objectif d'une stratégie à long terme pourrait être d'altérer les interactions entre CARP3 et les adénylate cyclases. Cela pourrait se faire, par exemple, au moyen d'un peptide synthétique qui serait produit chez les mouches en utilisant la technique connue sous le nom de paratransgenèse. Sans coloniser les glandes salivaires des glossines, les trypanosomes ne seraient plus transmis. Comment Nagana est transporté par les mouches tsé-tsé