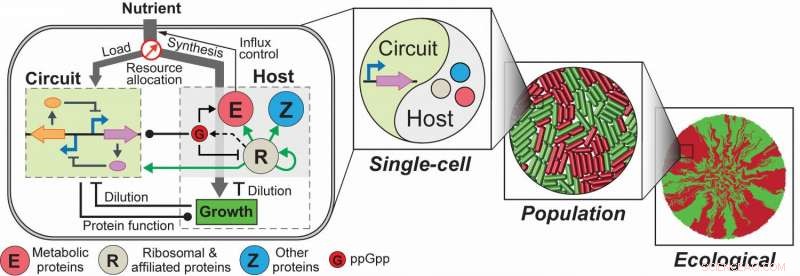
Interactions circuit-hôte et leurs conséquences à toutes les échelles. Les circuits synthétiques et l'hôte forment une dynamique, relation multicouche impliquant à la fois des interactions génériques et spécifiques au système, régularisant ainsi mutuellement les comportements des uns et des autres. Comme le couplage circuit-hôte modifie la croissance cellulaire, les influences du couplage peuvent se propager à travers les échelles, impactant la dynamique unicellulaire, comportements des populations et émergence de l'écologie spatiale. Ici, les cellules rouges et vertes représentent deux phénotypes distincts causés par les interactions circuit-hôte; les taches vertes et rouges sont des amas cellulaires formés par les deux phénotypes. Crédit: Microbiologie naturelle , DOI :10.1038/s41564-017-0022-5
Au cours des 17 dernières années, les scientifiques et les ingénieurs ont développé des circuits de gènes synthétiques qui peuvent programmer la fonctionnalité, performance, et le comportement des cellules vivantes. Analogue aux circuits intégrés qui sous-tendent une myriade de produits électroniques, des circuits génétiques modifiés peuvent être utilisés pour générer une dynamique définie, recâbler les réseaux endogènes, sentir les stimuli environnementaux, et produire des biomolécules précieuses.
Ces circuits de gènes sont très prometteurs dans les applications médicales et biotechnologiques, comme la lutte contre les super bugs, produire des biocarburants avancés, et la fabrication de matériaux fonctionnels.
À ce jour, la plupart des circuits sont construits par essais et erreurs, qui repose fortement sur l'intuition d'un concepteur et est souvent inefficace, a déclaré le professeur agrégé de bioingénierie de l'Université de l'Illinois, Ting Lu. "Avec l'augmentation de la complexité des circuits, le manque de directives de conception prédictive est devenu un défi majeur dans la réalisation du potentiel de la biologie synthétique, " dit Lou, qui est également affilié au Carl R. Woese Institute for Genomic Biology and Physics Department de l'Illinois.
Les chercheurs se sont tournés vers la modélisation quantitative pour relever ce défi de conception de circuits génétiques. Les modèles typiques considèrent les circuits de gènes comme des entités isolées qui n'interagissent pas avec leurs hôtes et se concentrent uniquement sur les processus biochimiques au sein des circuits, a noté Lu.
« Bien que très précieux, le paradigme de modélisation actuel est souvent incapable de voire qualitativement parfois, décrire les comportements des circuits, ", a-t-il déclaré. "De plus en plus de preuves expérimentales ont suggéré que les circuits et leur hôte biologique sont intimement connectés et que leur couplage peut avoir un impact significatif sur les comportements des circuits."
Lu et ses étudiants diplômés, Chen Liao et Andrew Blanchard, récemment relevé le défi en construisant un cadre de modélisation intégré pour décrire quantitativement et prédire les comportements des circuits géniques. À l'aide de Escherichia coli ( E. coli ) en tant qu'hôte modèle, le cadre consiste en une description grossière mais mécaniste de la physiologie de l'hôte qui implique un partitionnement dynamique des ressources, couplage circuit-hôte multicouche, et un module cinétique détaillé des circuits exogènes.
L'équipe a démontré que, après une formation, le cadre a été capable de capturer et de prédire un grand nombre de données expérimentales concernant l'hôte et la surexpression simple du gène. Par exemple, ils ont découvert que les effets médiés par ppGpp sont la clé pour comprendre l'expression génique constitutive sous les changements environnementaux, y compris les changements de nutriments et d'antibiotiques. L'équipe a également démontré l'utilité de la plate-forme en l'appliquant pour examiner un circuit de rétroaction modulant la croissance dont la dynamique est qualitativement altérée par les couplages circuit-hôte et révélant les comportements d'un interrupteur à bascule à travers les échelles de la dynamique unicellulaire à la structure de la population et à écologie spatiale.
Bien que le cadre de Lu ait été établi en utilisant E. coli comme hôte modèle, il a le potentiel d'être généralisé pour décrire plusieurs organismes hôtes. "Par exemple, nous avons trouvé que, en ne faisant varier qu'un seul paramètre, le framework a prédit avec succès plusieurs métriques clés de l'hôte, y compris le rapport ARN/protéine, Contenu en ARN par cellule, et le taux d'allongement moyen des peptides, pour Salmonelle typhimurium et Streptomyces coelicolor , " dit Lou.
Selon Lou, ce travail fait progresser la compréhension quantitative des comportements des circuits génétiques, et facilite la transformation de la conception de réseaux de gènes de la construction par essais et erreurs à une ingénierie avancée rationnelle. En illustrant systématiquement les processus cellulaires clés et les interactions multicouches circuit-hôte, il éclaire en outre la biologie quantitative vers une meilleure compréhension de la physiologie bactérienne complexe.
Le travail est décrit dans l'article de Lu, "Un cadre de modélisation intégrative de circuit-hôte pour prédire les comportements de réseaux de gènes synthétiques, " publié le 25 septembre Numéro 2017 de Microbiologie naturelle .