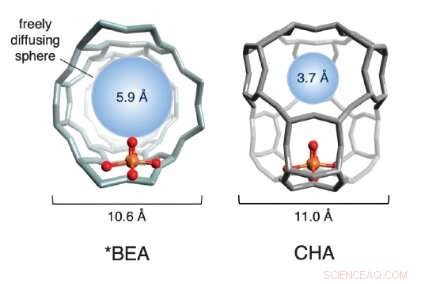
Une illustration des structures en cage de deux zéolithes à base de fer utilisées dans l'étude. Les sphères rouge et or (représentant l'oxygène et le fer, respectivement) constituent le site actif. La structure de la cage, en gris, est formé de silicium, aluminium et oxygène. La sphère bleue quantifie la taille de la plus grosse molécule qui peut diffuser librement dans et hors de la cage du site actif (le diamètre du méthane est d'environ 4,2 ). Crédit :Benjamin Snyder
Une équipe de chercheurs de l'Université de Stanford et de l'Université de Louvain en Belgique a élucidé un processus intrigant qui pourrait être une étape importante vers une économie de carburant au méthanol avec du méthane abondant comme matière première, une avancée qui pourrait changer fondamentalement la façon dont le monde utilise le gaz naturel.
Le méthanol, l'alcool le plus simple, est utilisé pour fabriquer divers produits, comme les peintures et les plastiques, et comme additif à l'essence. Riche en hydrogène, le méthanol peut alimenter des piles à combustible de nouvelle génération qui pourraient apporter des avantages environnementaux significatifs.
Si le gaz naturel, dont le méthane est le composant principal, pourrait être converti économiquement en méthanol, le combustible liquide résultant serait beaucoup plus facile à stocker et à transporter que le gaz naturel et l'hydrogène pur. Cela réduirait également considérablement les émissions de méthane des usines de traitement du gaz naturel et des pipelines. Aujourd'hui, méthane échappé, un gaz à effet de serre beaucoup plus puissant que le dioxyde de carbone, nie presque les avantages environnementaux du gaz naturel par rapport au pétrole et au charbon. La nouvelle étude de l'équipe dans l'édition actuelle de Science est leur dernier à proposer une méthode à faible consommation d'énergie pour produire du méthanol à partir de méthane.
"Ce processus utilise des cristaux communs connus sous le nom de zéolites de fer qui sont connus pour convertir le gaz naturel en méthanol à température ambiante, " explique Benjamin Snyder, qui a obtenu son doctorat à Stanford en étudiant les catalyseurs pour relever les principaux aspects de ce défi. "Mais, c'est une chimie extrêmement difficile à réaliser sur le plan pratique, car le méthane est obstinément chimiquement inerte."
Lorsque le méthane est infusé dans des zéolithes de fer poreuses, le méthanol est rapidement produit à température ambiante sans besoin de chaleur ou d'énergie supplémentaire. Par comparaison, le procédé industriel conventionnel de fabrication de méthanol à partir de méthane nécessite des températures de 1000°C (1832°F) et une pression extrêmement élevée.
"C'est un processus économiquement alléchant, mais ce n'est pas si facile. Des barrières importantes empêchent la mise à l'échelle de ce processus à des niveaux industriels, " dit Edouard Salomon, Professeur de chimie et de science des photons à Stanford au SLAC National Accelerator Laboratory. Solomon est l'auteur principal de la nouvelle étude.
Garder les zéolites allumées
Malheureusement, la plupart des zéolites de fer se désactivent rapidement. Incapable de traiter plus de méthane, le processus s'essouffle. Les scientifiques ont souhaité étudier des moyens d'améliorer les performances de la zéolite de fer. La nouvelle étude, co-écrit par Hannah Rhoda, un doctorant de Stanford en chimie inorganique, utilise la spectroscopie avancée pour explorer la structure physique des zéolites les plus prometteuses pour la production de méthane en méthanol.

Hannah Rhoda avec l'équipement de spectroscopie Raman à résonance, qui tire un laser dans un échantillon pour obtenir des informations vibratoires du site exact étudié. Les chercheurs de la présente étude ont utilisé cette technique pour aider à attribuer les sites empoisonnés Fe(III)-OH et Fe(III)OCH3, qui éclairait le mécanisme. Crédit :Hannah Rhoda
"Une question clé ici est de savoir comment extraire le méthanol sans détruire le catalyseur, " dit Rhoda.
Choisir deux zéolithes de fer attractives, l'équipe a étudié la structure physique des réseaux autour du fer. Ils ont découvert que la réactivité varie considérablement en fonction de la taille des pores de la structure cristalline environnante. L'équipe l'appelle "l'effet cage, " car le treillis d'encapsulation ressemble à une cage.
Si les pores des cages sont trop gros, le site actif se désactive après un seul cycle de réaction et ne se réactive plus jamais. Lorsque les ouvertures des pores sont plus petites, cependant, ils coordonnent une danse moléculaire précise entre les réactifs et les sites actifs du fer, une danse qui produit directement du méthanol et régénère le site actif. En tirant parti de ce que l'on appelle « l'effet de cage », ' l'équipe a pu réactiver 40 pour cent des sites désactivés à plusieurs reprises, une avancée conceptuelle significative vers un processus catalytique à l'échelle industrielle.
« Le cycle catalytique – la réactivation continue des sites régénérés – pourrait un jour conduire à une production économique de méthanol à partir de gaz naturel, " dit Snyder, maintenant boursier postdoctoral à l'UC-Berkeley dans le département de chimie sous la direction de Jeffrey R. Long.

Benjamin Snyder (à droite) et son ancien directeur de thèse, Edouard Salomon, professeur de chimie à Stanford et de science des photons au SLAC. Crédit :Linda A. Cicéron
Cette avancée fondamentale dans la science fondamentale aidera à élucider pour les chimistes et les ingénieurs chimistes le procédé utilisé par les zéolites de fer pour produire du méthanol à température ambiante, mais il reste beaucoup de travail avant qu'un tel procédé puisse être industrialisé.
Suivant sur la liste de Snyder :s'attaquer à la réalisation du processus non seulement à température ambiante, mais en utilisant l'air ambiant plutôt qu'une autre source d'oxygène, comme le protoxyde d'azote utilisé dans ces expériences. Faire face à un agent oxydant puissant comme l'oxygène, qui est notoirement difficile à contrôler dans les réactions chimiques, sera un autre obstacle considérable le long du chemin.
Pour l'instant, Snyder était à la fois ravi et étonné par les pouvoirs illustratifs de l'instrumentation spectroscopique sophistiquée des laboratoires de Salomon qui ont été mis à profit pour cette étude. Ceux-ci étaient inestimables pour sa compréhension de la chimie et des structures chimiques impliquées dans le processus de transformation du méthane en méthanol.
"C'est cool de voir comment vous pouvez obtenir des informations très puissantes au niveau atomique, comme l'effet cage, à partir de ces outils qui n'étaient pas disponibles pour les générations précédentes de chimistes, " dit Snyder.