Schéma montrant le développement d'un nouveau système catalysé au Ni qui convertit des oléfines monosubstituées bon marché et facilement disponibles en analogues tri- et tétrasubstitués de grande valeur, et son application à la synthèse de composés bioactifs complexes. Crédit: Catalyse naturelle / Université nationale de Singapour
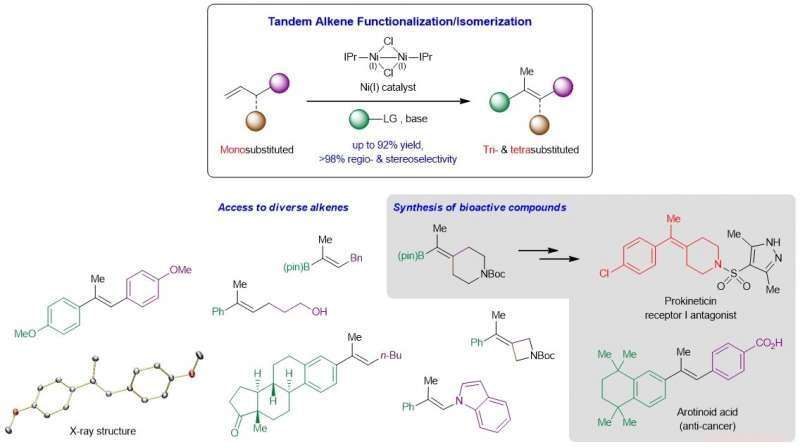
Les chimistes de NUS ont développé une nouvelle façon d'accéder à des alcènes tri- et tétrasubstitués prisés grâce à un processus en tandem catalysé au nickel impliquant une réaction de Heck suivie d'une migration de la double liaison carbone-carbone (C=C).
Le développement de méthodes fiables permettant d'obtenir des alcènes acycliques tri- et tétrasubstitués stéréochimiquement définis est un objectif de longue date de la synthèse organique. Ces liaisons C=C hautement substituées résident généralement dans d'innombrables molécules d'intérêt, notamment des matériaux organiques et des entités biologiquement actives, et sont des intermédiaires clés pour une dérivatisation plus poussée vers un éventail plus large de produits de grande valeur. Les réactions existantes qui convertissent des composés carbonylés ou des liaisons carbone-carbone insaturées en oléfines tri- et tétrasubstituées impliquent souvent de longues voies de synthèse, présenter une compatibilité limitée des groupes fonctionnels, souffrent d'un contrôle de régio- ou de stéréosélectivité insatisfaisant, et/ou ne sont pas suffisamment généraux. Une complication provient de la faible différence d'énergie entre le cis et trans isomères de ces alcènes hautement substitués, ce qui augmente la difficulté de générer ces composés en haute stéréosélectivité.
Une équipe de recherche dirigée par le professeur Koh Ming Joo, du Département de chimie, Université nationale de Singapour en collaboration avec le professeur Osvaldo Gutierrez, de l'Université du Maryland, a conçu une stratégie en tandem qui fusionne la réaction de Heck régio-contrôlée et la migration de liaison C=C stéréo-contrôlée en une seule étape (voir Figure). Des études mécanistiques et informatiques ont montré que la réaction se déroule par une voie non radicale, et qu'à la fois la base alcoxyde importante et N -le ligand carbène hétérocyclique (NHC) est crucial pour le processus catalytique.
Le professeur Koh a dit, "Notre incursion initiale dans ce domaine de recherche était de demander hypothétiquement comment pouvons-nous transformer des α-oléfines monosubstituées, une classe très abondante de matières premières chimiques, aux analogues trisubstitués et tétrasubstitués plus précieux mais difficiles à synthétiser, en un seul processus. Comme il s'avère, la solution à cela était de concevoir une réaction en tandem qui réagit d'abord avec le substrat monosubstitué, puis l'isomérise en le produit désiré. Un contrôle bien orchestré de la régio- et de la stéréosélectivité était primordial, ce qui nous a amenés à découvrir l'efficacité unique des catalyseurs au nickel ligaturés par NHC."
"Nous attendons de notre nouvelle méthodologie qu'elle améliore la manière dont de nombreuses molécules bioactives sont synthétisées, et servir de modèle pour la conception de transformations catalytiques en tandem pour construire des blocs de construction importants à partir de matériaux non précieux, " a ajouté le professeur Koh.
L'équipe de recherche prévoit d'exploiter les connaissances acquises à partir de ces travaux pour développer de nouvelles transformations en tandem pour faciliter la synthèse chimique fine.