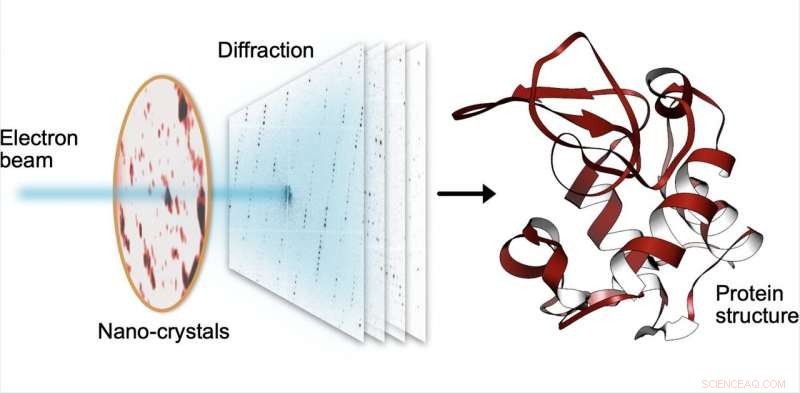
En diffraction électronique en série, un petit faisceau d'électrons frappe séquentiellement des milliers de minuscules cristaux fabriqués à partir de protéines, qui diffusent le faisceau en diagrammes de diffraction. De ces modèles, la structure des protéines peut être déterminée avec une haute résolution. Crédit :Robert Bücker
Comprendre la structure des protéines, les éléments constitutifs de la vie, est essentiel pour comprendre leur fonction biologique. En raison de leur taille minuscule et de leur extrême fragilité, ces structures sont extrêmement difficiles à déterminer. L'acquisition de données d'une résolution suffisante nécessite d'immenses doses de rayonnement X à haute énergie, ce qui malheureusement endommage irrévocablement les protéines principalement étudiées.
Désormais, des chercheurs du MPSD et de DESY à Hambourg ont mis au point une nouvelle méthode inventive qui évite ces écueils et utilise des technologie rentable. Leurs travaux décrivant la nouvelle méthode ont maintenant été publiés dans Communication Nature .
Depuis des décennies, chercheurs de nombreux domaines tels que la physique, la biologie, et la biochimie ont déployé leur créativité pour contourner l'énigme des dommages causés par les radiations. Les approches actuelles comprennent l'utilisation de flashs de rayons X extrêmement courts et intenses dans des installations telles que le nouveau laser européen à électrons libres de rayons X (EuXFEL) à Hambourg, qui peut prendre des images bien exposées de protéines avant de les faire littéralement exploser.
Bien que cette méthode ait réussi de manière spectaculaire à obtenir des structures protéiques à haute résolution, générer des faisceaux de rayons X de la luminosité requise nécessite l'utilisation de grands et coûteux accélérateurs de particules. Une alternative très efficace, qui est intensivement pratiqué au Centre de biologie des systèmes structurels (CSSB) à Hambourg, par exemple, est de renoncer complètement aux rayons X, et utilisez plutôt des faisceaux d'électrons, qui sont plus doux pour les biomolécules délicates et plus faciles à générer.

Un film au ralenti sur la collecte de motifs de diffraction (à gauche) à partir de milliers de minuscules cristaux (à droite) dans un microscope électronique. Crédit :Robert Bücker
L'équipe de recherche MPSD/DESY du Center for Free-Electron Laser Science (CFEL) a ingénieusement combiné de telles méthodologies avec le calcul des mégadonnées et les récentes améliorations de la technologie des caméras et a réussi à obtenir des structures de protéines à haute résolution à partir de nanocristaux relativement faciles à obtenir. Pour y parvenir, ils ont développé une technique appelée diffraction électronique en série en adaptant des méthodes expérimentales déjà connues dans la communauté de la cristallographie aux rayons X pour acquérir et traiter séquentiellement des motifs de diffraction à partir de milliers de cristaux.
Au lieu de déployer un instrument d'un milliard d'euros comme l'EuXFEL, ils ont simplement réparti ces cristaux sur une fine couche de carbone et les ont insérés dans un microscope électronique à transmission, un appareil disponible partout. Le faisceau d'électrons est amené à sauter d'un nanocristal à l'autre afin d'acquérir des données de diffraction. Outre des économies de matière sur des échantillons souvent rares et coûteux, l'utilisation de nanocristaux signifie que les chercheurs n'ont plus à cultiver de gros cristaux de protéines comme l'exigent les anciennes méthodes (rayons X), une entreprise qui s'avère souvent d'une difficulté prohibitive.
Pour contourner les dommages causés par le faisceau d'électrons, au lieu de ne prendre qu'une seule photo, un court métrage est enregistré à l'aide d'une caméra ultra-rapide pendant que le faisceau d'électrons repose sur chaque cristal. Dans le film, on peut littéralement regarder les protéines dans le cristal "fondre" - cependant, il y a suffisamment d'informations dans ce film de diffraction pendant la destruction pour reconstruire les données presque comme s'il n'y avait eu aucun dommage. Cette procédure est répétée pour des milliers de nanocristaux, et en quelques heures, à l'aide d'un logiciel spécialisé développé à DESY, la quantité massive de données est convertie en une structure protéique à haute résolution.
En plus des protéines et autres biomolécules, la diffraction électronique en série est également applicable à de nombreuses classes de nouveaux matériaux fonctionnels, tels que les pérovskites et les charpentes métallo-organiques, tous des candidats prometteurs pour de futures applications dans les cellules solaires et le stockage de l'hydrogène. L'équipe de recherche est enthousiasmée par la facilité d'utilisation de cette technique innovante, avec ses faibles besoins en équipement et sa large applicabilité. Ils prévoient qu'il se propagera du MPSD aux laboratoires du monde entier.