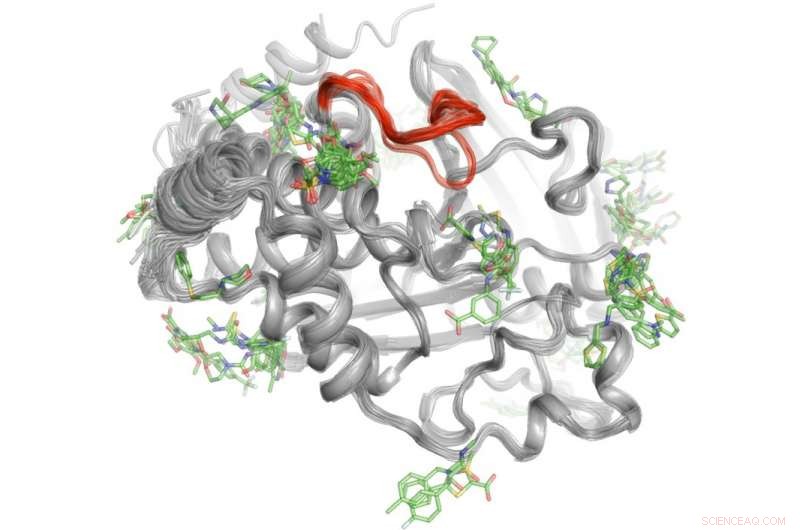
Une méthode à haut débit révèle où plus de 100 petites molécules se lient à la protéine PTP1B. Quelques-unes de ces zones de liaison peuvent envoyer des signaux au site actif (rouge) pour contrôler l'activité de PTP1B." Crédit :Daniel Keedy
Les protéines de notre corps sont des structures sophistiquées qui effectuent des tâches spécifiques pour nous permettre de fonctionner et de rester en bonne santé. Dans de nombreux cas, ces minuscules machines sont allumées ou éteintes par un processus en deux étapes où une partie de la protéine envoie des messages à une autre partie appelée le "site actif, " déclenchant le démarrage ou l'arrêt de la protéine. Parfois, ce processus, appelé allostère, est perturbé, qui conduit ou contribue au développement de certaines maladies.
Comprendre comment une protéine est câblée pourrait aider les chercheurs à développer des moyens de contrôler son activité, et des scientifiques du Advanced Science Research Center (ASRC) du Graduate Center, CUNY, croire qu'ils ont trouvé un moyen fiable de le déterminer, selon une étude récemment publiée dans eLife .
"Tout comme il est difficile de deviner comment un interrupteur est connecté à une ampoule dans une pièce sans voir derrière les murs, il est difficile de prédire quelle zone éloignée d'une protéine est connectée à son site actif sans voir les détails à l'intérieur de la structure, " a déclaré Daniel Keedy, professeur adjoint à l'Initiative de biologie structurale de l'ASRC et aux départements de chimie et de biochimie du City College of New York.
Pour résoudre ce mystère, Keedy et ses collègues ont exploré les capacités de signalisation de la protéine tyrosine phosphatase 1B (PTP1B), qui, selon les chercheurs, joue un rôle important dans le diabète de type 2 et peut-être le cancer du sein. Ils ont d'abord utilisé la cristallographie aux rayons X à différentes températures pour voir comment les atomes à l'intérieur de la protéine se déplacent. Cela a révélé des zones spécifiques où les atomes se déplacent comme des essuie-glaces ou un jouet de berceau de Newton pour envoyer des messages. Prochain, l'équipe a réalisé des expériences à haut débit avec la protéine pour déterminer quelles petites molécules se lient à ces sites de signalisation.
"Ce processus en deux étapes nous a permis de voir non seulement d'où provient la signalisation à l'intérieur de PTP1B, mais aussi quelles petites molécules sont capables d'envoyer des messages au site actif. Ces connaissances pourraient un jour nous aider à développer des thérapies qui envoient des messages spécifiques pour contrôler l'activité d'une protéine et perturber le développement du diabète de type 2, " a déclaré Kedy.
"Je suis assez sensible aux applications potentielles du travail de Daniel, " a déclaré Kevin Gardner, directeur de l'Initiative de biologie structurale de l'ASRC et professeur Einstein de chimie et de biochimie au City College. "Cette technique fournit une voie expérimentale puissante pour demander où les petites molécules peuvent se lier aux cibles protéiques, permettant la découverte et le développement de médicaments en montrant où l'on pourrait trouver des « points d'ancrage » auparavant imprévus pour que les composés se lient et contrôlent l'activité des protéines. »
Keedy et ses collègues n'ont jusqu'à présent examiné que PTP1B, mais leur méthode utilise des technologies facilement disponibles qui peuvent être utilisées pour étudier le processus d'allostère dans de nombreuses autres protéines importantes dans notre corps. Ils espèrent mieux comprendre comment les fonctions de ces autres protéines sont contrôlées, qui pourraient être utiles pour le développement futur de nouvelles thérapies médicamenteuses.