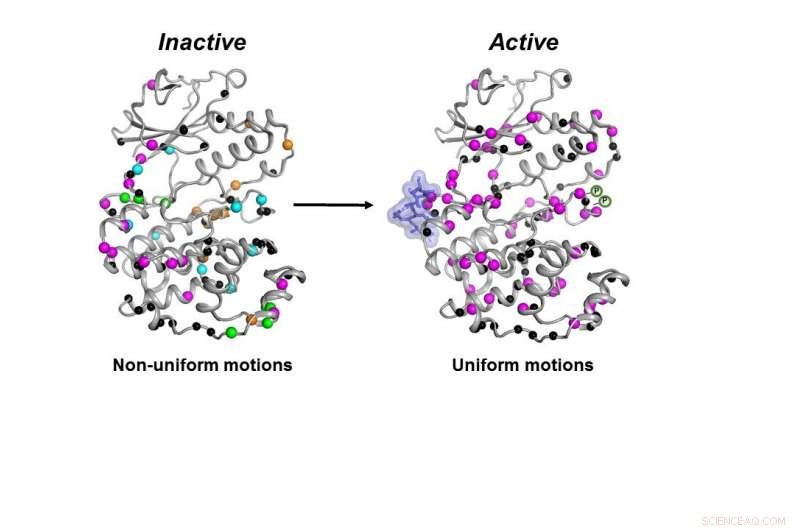
La forme inactive (à gauche) de l'enzyme MAPK p38 se déplace de manière non coordonnée. Une fois que les molécules nécessaires (bleu blob et symboles P) se lient, l'enzyme devient active (à droite) en se déplaçant de manière coordonnée pour faire son travail à l'intérieur d'une cellule. Crédit :Senthil Ganesan, Département de chimie et de biochimie de l'Université de l'Arizona.
Révéler toutes les étapes nécessaires pour activer une enzyme appelée protéine kinase peut identifier de nouvelles façons de cibler le cancer, selon une nouvelle recherche menée par l'Université de l'Arizona.
Non seulement la kinase doit avoir toutes les pièces nécessaires en place, l'enzyme doit se déplacer de la bonne manière et à la bonne vitesse pour fonctionner correctement dans une cellule, les chercheurs ont trouvé.
Premier auteur Senthil Kumar Ganesan, un professeur assistant de recherche UA en chimie et biochimie, lesdites kinases sont des commutateurs qui activent ou désactivent certains processus cellulaires. Si les kinases d'une cellule cessent de fonctionner, la cellule mourrait.
L'équipe dirigée par UA est le premier groupe à comprendre la voie complète pour activer une protéine kinase, a déclaré l'auteur principal Wolfgang Peti, qui détient la chaire Homer C. et Emily Davis Weed Endowed en chimie à l'Université de l'Arizona.
« Les kinases sont l'une des principales cibles des médicaments anticancéreux, " dit Peti, qui est également membre de l'Institut UA BIO5 et de l'UA Cancer Center. "Si vous savez comment fonctionne une kinase, vous pouvez certainement mieux concevoir vos médicaments contre cela."
Le développement d'un médicament qui tire parti de cette nouvelle découverte de la recherche prendra probablement au moins 10 ans, il a dit.
Les médicaments anticancéreux déjà utilisés qui ciblent les kinases sont le dasatinib et l'imatinib pour la leucémie myéloïde chronique et l'afatinib pour le carcinome pulmonaire non à petites cellules, dit Ganesan.
Pour observer une kinase appelée protéine kinase activée par un mitogène (MAPK) p38 en action, les chercheurs ont utilisé la spectroscopie par résonance magnétique nucléaire (RMN).
Toutes les molécules nécessaires devaient se lier à p38 pour que l'enzyme devienne active. Ce n'est qu'alors que l'enzyme pourrait se déplacer correctement pour faire son travail dans la cellule, les chercheurs ont trouvé.
"Nous avons compris comment il se déplace pour faire son travail et quelle est la contribution de la vitesse de déplacement à son travail, " dit Peti.
La découverte suggère qu'une nouvelle voie pour développer des médicaments anticancéreux pourrait être la création de médicaments qui interfèrent avec le mouvement de p38, il a dit.
« Nous sommes ravis car cette kinase appartient à une famille de kinases appelées MAP kinases, des kinases de signalisation clés qui régulent une pléthore de voies (à l'intérieur des cellules), " il a dit.
Peti a déclaré que la nouvelle découverte pourrait s'appliquer à d'autres kinases. Il a déclaré que les nombreuses enzymes kinases dans le corps sont très similaires et ont probablement des voies d'activation similaires.
Ganesan, Peti et leurs co-auteurs ont publié l'article, "Activation dynamique et régulation de la protéine kinase p38 activée par les mitogènes, " dans le numéro du 1er mai du Actes de l'Académie nationale des sciences .
Leurs co-auteurs sont Michael W. Clarkson et Rebecca Page de l'Université de l'Arizona; Micha B.A. Kunze, Daniele Granata et Kresten Lindorff-Larsen de l'Université de Copenhague au Danemark; et A. Joshua Wand de l'Université de Pennsylvanie à Philadelphie.
La subvention NIH-R01GM100910 des National Institutes of Health a financé la recherche. Les données ont été recueillies dans les installations du UA Molecular Structures Core et du Brown University Structural Biology Core.
Une analogie souvent utilisée pour le fonctionnement des enzymes est celle d'une serrure et d'une clé. Une molécule particulière, la clé, s'insère dans un site de l'enzyme, le verrou. Une fois la clé dans la serrure, l'enzyme peut commencer à fonctionner.
La clé dans la serrure est nécessaire pour qu'une enzyme fonctionne, mais activer une enzyme n'est pas toujours aussi simple. Certains scientifiques ont suggéré que la dynamique - la manière et la vitesse à laquelle une enzyme se déplace - est importante pour l'activation des enzymes kinases.
Peti s'intéresse à la façon dont les molécules telles que les kinases régissent les processus avec les cellules, il a donc voulu étudier le rôle joué par la dynamique. En savoir plus sur le fonctionnement des molécules à l'intérieur des cellules peut aider à développer des médicaments ciblés pour lutter contre le cancer et d'autres maladies.
Déterminer le rôle que joue la dynamique dans l'activation de p38 a été plus difficile et a pris plus de temps que prévu.
L'outil que les scientifiques utilisent pour observer une enzyme en action, spectroscopie RMN, est plus difficile avec une grosse molécule comme p38. En outre, l'équipe a dû développer un nouveau logiciel informatique pour analyser les résultats, dit Peti.
Les chercheurs ont observé l'enzyme au cours d'une série d'étapes en tant que diverses molécules clés liées à p38. Certaines enzymes s'activent lorsque des molécules clés se lient, mais pas celle-ci.
"Si vous pensez que passer de zéro à 100 est un processus en cinq ou six étapes, nous pensions qu'aux étapes zéro, une, deux ou trois, nous obtiendrions des indications ou des lignes directrices, " dit Peti.
Cela ne s'est pas produit. Il a dit que les chercheurs ont pensé à abandonner.
"Rien ne fonctionnait, et il semblait que notre hypothèse était complètement fausse, " il a dit.
"Ce que nous avons, c'est que rien ne se passe de zéro à un, il ne se passe rien de un à deux, il ne se passe rien de deux à trois, il ne se passe rien de trois à quatre, » dit Peti. « Quand tu passes de quatre à cinq :Boum ! Tout à coup, c'était là."
Une fois toutes ces étapes franchies, bien que la forme de p38 n'ait pas changé, sa dynamique a fait, dit-il, et ce changement final de dynamique était nécessaire pour que l'enzyme fonctionne.
La prochaine étape de l'équipe, Peti a dit, cherche à savoir si le mouvement des kinases joue un rôle dans le diabète.