De nombreuses maladies peuvent être traitées avec succès dans l’environnement simple d’une boîte de culture cellulaire, mais pour réussir à traiter de vraies personnes, l’agent médicamenteux doit parcourir l’environnement infiniment plus complexe de notre corps et arriver intact à l’intérieur des cellules affectées. Ce processus, appelé administration de médicaments, est l'un des obstacles les plus importants en médecine.
Une collaboration entre le Lawrence Berkeley National Laboratory (Berkeley Lab) et Genentech, membre du groupe Roche, s'efforce de résoudre certains des goulots d'étranglement liés à l'administration de médicaments en concevant les nanoparticules lipidiques (LNP) les plus efficaces :de minuscules poches sphériques constituées de molécules grasses. qui encapsulent des agents thérapeutiques jusqu’à ce qu’ils s’arriment aux membranes cellulaires et libèrent leur contenu. Le premier médicament à utiliser des LNP a été approuvé en 2018, mais la méthode d'administration a pris une importance mondiale avec les vaccins à ARNm COVID de Pfizer et Moderna.
"C'est un système assez intelligent, car si vous délivrez simplement l'ARN lui-même au corps humain, l'ARN est dégradé par les nucléases et ne peut pas facilement traverser la membrane cellulaire en raison de sa taille et de sa charge, mais les LNP le délivrent en toute sécurité dans la cellule", " a expliqué le co-auteur principal Chun-Wan Yen, scientifique principal principal du groupe des sciences pharmaceutiques des petites molécules de Genentech.
Les LNP sont désormais largement explorées en tant que système d’administration de vaccins contre d’autres maladies infectieuses ou de vaccins thérapeutiques contre le cancer. La viabilité de ces nouvelles applications dépendra de la qualité de la fusion des enveloppes lipidiques avec les cellules cibles, de la stabilité des formulations médicament-LNP lors du stockage (afin qu'elles aient une longue durée de conservation) et de leur stabilité dans l'organisme. (afin qu'ils puissent conférer une activité médicamenteuse prolongée).
Toutes ces propriétés sont contrôlées par le mélange de molécules utilisé pour créer le LNP et par la structure 3D résultante de la particule. L'équipe dirigée par Yen et ses collègues co-responsables Greg Hura et Michal Hammel, tous deux biophysiciens du Berkeley Lab, étudient depuis plusieurs années comment ajuster la structure des LNP pour les propriétés souhaitées.
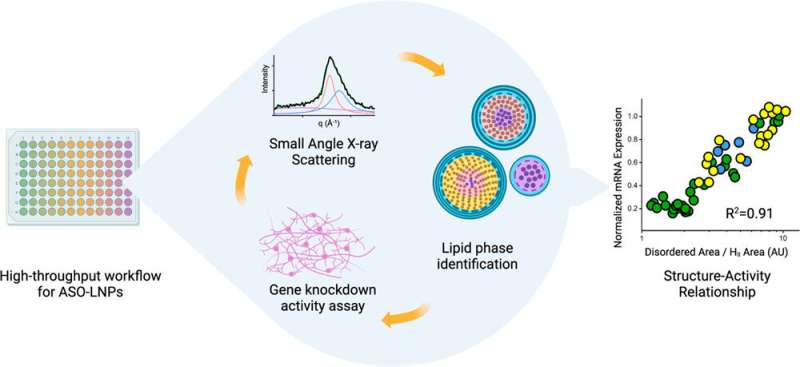
Leur dernier article, publié récemment dans ACS Nano , documente comment un flux de travail à haut débit leur permet de produire et de caractériser des LNP à une vitesse record. L'étude comprend également la toute première démonstration de la façon dont la structure du LNP est en corrélation avec l'activité de son contenu, qui pour cette enquête était un oligonucléotide antisens (ASO). Les ASO sont de petits extraits de paires de bases d’ARN ou d’ADN qui bloquent l’expression des gènes en se liant aux brins d’ARNm et en les empêchant d’être traduits en protéines. Les ASO sont un excellent moyen de traiter les maladies causées par des protéines défectueuses ou par la surabondance d’une protéine. Mais, comme l'ARNm, ils sont sensibles aux nucléases errantes (des enzymes qui dégradent l'ARN et l'ADN) et les cellules ne les absorbent pas facilement.
Les scientifiques ont découvert que les LNP porteurs d’ASO et dotés de structures internes bien ordonnées et serrées conduisaient à une meilleure inactivation d’un gène défectueux dans les neurones humains associé à une maladie dégénérative, par rapport aux LNP ayant une structure plus désordonnée. Les résultats proviennent d'activités cellulaires et non d'études animales. Il reste donc encore du travail à faire, mais l'équipe est ravie de s'appuyer sur ces connaissances en utilisant les outils complémentaires de chaque institution.

"Nous générons les LNP à haut débit et l'équipe de Greg et Michal peut proposer l'analyse à haut débit", a déclaré Yen. "Si vous vérifiez la publication de nos jours, ils ne font généralement qu'une ou deux formulations, mais pour nous, c'est différent. Nous pouvons générer de grands ensembles de données, et je pense que c'est la raison pour laquelle nous pouvons obtenir cette découverte très unique et intéressante."
"Cet article présente réellement la méthode que nous allons appliquer aux milliers d'autres formulations que nous avons l'intention de caractériser", a ajouté Hura, qui fait partie du domaine des biosciences du Berkeley Lab. "Nous espérons que ce sera une méthode générale permettant aux gens d'optimiser leurs nanoparticules lipidiques. Qu'il s'agisse de vaccins, et encore une fois, les vaccins ont reçu la plus grande attention jusqu'à présent, voire au-delà. Ce type de thérapie a une application très large au-delà de cela. ."
Les structures des LNP sont affectées par la manière dont vous les mélangez, ce que vous mélangez et dans quel ordre. Les LNP contiennent quatre ingrédients :des lipides ionisables, des phospholipides auxiliaires, du cholestérol et des lipides de polyéthylène glycol (PEG-lipides) - et chaque ingrédient a des formes différentes. De plus, ils peuvent être combinés dans différents ratios, conduisant à un nombre exponentiel de formules possibles. Pour compliquer encore les choses, les LNP changent avec le temps. Une formulation qui commence comme une sphère soignée et compacte finira par se transformer en une structure plus désordonnée.
Les scientifiques de Genentech ont développé un flux de travail piloté par robot capable de générer des centaines de formulations de LNP en quelques heures seulement. Des échantillons de chaque formulation sont ensuite amenés au laboratoire de Berkeley pour effectuer une diffusion des rayons X aux petits angles (SAXS) à l'Advanced Light Source, un accélérateur de particules circulaire qui crée des faisceaux de rayons X de différentes énergies.
La ligne de lumière biologique SAXS peut traiter rapidement de nombreux échantillons et, contrairement à d'autres formes de diffraction des rayons X sur des matériaux biologiques, les échantillons n'ont pas besoin d'être congelés ou cristallisés, ce qui pourrait modifier la structure des LNP et empêcher les scientifiques de découvrir ce que représente l'échantillon. Les LNP ressembleraient aux températures physiologiques du corps humain. SAXS leur permet également de prendre des instantanés des LNP à des moments précis pour déterminer leur longévité structurelle.
De plus, l’équipe Genentech utilise un processus accéléré pour étudier comment les LNP affectent l’expression des gènes dans leurs cellules cibles. En combinant toutes ces techniques accélérées, l'ensemble de la collaboration est capable de dépister les LNP potentielles à un rythme sans précédent.
Yen prévoit de continuer à utiliser la ligne de lumière SAXS pour étudier de petits détails, comme la façon dont un changement de 1 % dans la concentration des ingrédients ou l'utilisation d'une nouvelle machine pendant la production peut affecter l'activité cellulaire du LNP, ainsi que de grandes questions, comme par exemple si les LNP se comportent différemment s'ils le sont. transportant d'autres types de marchandises et comment elles interagissent avec différentes cellules cibles.
"Nous savons que les LNP d'ARNm fonctionnent, mais il existe encore un énorme déficit de connaissances", a déclaré Yen. "C'est pourquoi j'ai l'impression que notre article est un pionnier dans ce domaine et j'espère que nous pourrons également générer plus de données et de compréhension pour les applications futures."
Plus d'informations : Michal Hammel et al, Corrélation de la structure et de l'activité de silençage génique de nanoparticules lipidiques chargées d'oligonucléotides à l'aide de la diffusion des rayons X aux petits angles, ACS Nano (2023). DOI :10.1021/acsnano.3c01186
Informations sur le journal : ACS Nano
Fourni par le Laboratoire national Lawrence Berkeley