L'hydrogène gazeux est une alternative propre et renouvelable aux combustibles fossiles, mais les méthodes de production industrielle actuelles utilisées pour produire de l'hydrogène libèrent du carbone dans l'atmosphère et polluent l'environnement.
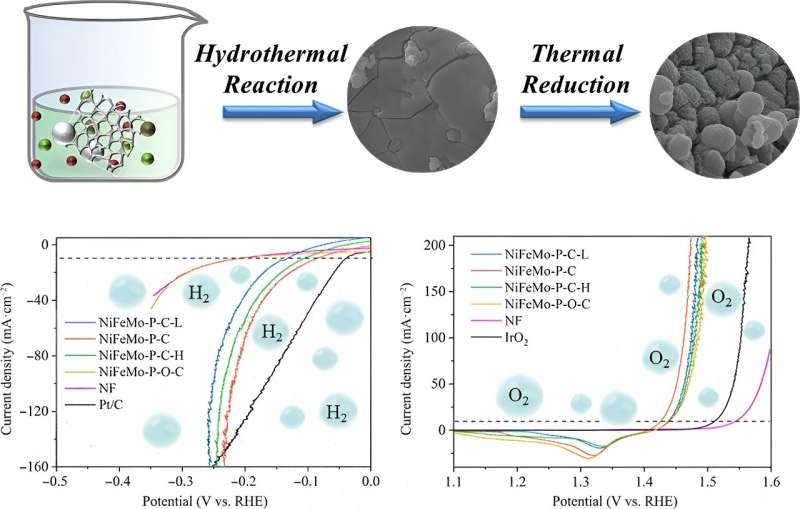
Un nouveau catalyseur, un composé de carbone nickel-fer-molybdène-phosphure ancré sur une mousse de nickel (NiFeMo-P-C), a considérablement réduit la quantité d'électricité nécessaire pour générer de l'hydrogène et de l'oxygène à partir de l'eau, fournissant ainsi un moyen propre et efficace de produire de l'hydrogène gazeux. .
Une équipe d'ingénieurs chimistes de premier plan a synthétisé un catalyseur économique et facile à fabriquer, conçu pour réduire la quantité d'énergie requise pour l'électrolyse de l'eau, qui divise les molécules d'eau en hydrogène et oxygène en utilisant l'électricité.
L'hydrogène et l'oxygène gazeux sont séparés de l'eau par la réaction de dégagement d'hydrogène (HER) et la réaction de dégagement d'oxygène (OER), respectivement. L'alliage de métaux de transition, ou un mélange contenant au moins un métal, le nickel-fer-molybdène (NiFeMo), a été utilisé comme catalyseur pour l'électrolyse de l'eau en raison du remplissage incomplet des orbitales électroniques dans les atomes de métaux de transition, le nickel et le fer, ce qui en fait un électron idéal. donneur et accepteur dans les réactions chimiques. Du phosphure a été ajouté au catalyseur pour améliorer la résistance à la corrosion dans une solution électrolytique alcaline ou basique.
L'équipe a publié les résultats de son étude dans Nano Research Energy. le 7 juillet.
« L'hydrogène est reconnu comme l'alternative la plus idéale aux combustibles fossiles en raison de sa densité énergétique élevée, de son efficacité de conversion thermique élevée et de ses émissions de carbone nulles. Cependant, les méthodes de production d'hydrogène couramment appliquées dans l'industrie, notamment le reformage à la vapeur du gaz naturel et du méthanol et la gazéification de charbon, consomment des combustibles fossiles et provoquent une grave pollution de l'environnement", a déclaré Jingjing Tang, superviseur de l'étude et professeur agrégé à l'Université Central South de Changsha, en Chine.
"L'électrolyse de l'eau utilise l'eau comme matière première pour produire de l'hydrogène de haute pureté en convertissant l'électricité en énergie chimique, ce qui constitue une technologie de production d'hydrogène propre et prometteuse", a déclaré Tang.
Les catalyseurs utilisés pour réduire l'énergie requise pour le HER et l'OER existaient auparavant, mais ils utilisaient de l'oxyde de platine et d'iridium, des éléments précieux à la fois coûteux et rares. La création d'un catalyseur abordable qui réduit l'énergie d'activation des deux réactions réduit les coûts de fabrication globaux et améliore la viabilité commerciale de la production d'hydrogène gazeux propre.
L'un des défis liés à la conception d'un catalyseur bifonctionnel résidait dans les exigences particulières des REL. "Étant donné que les REL sont une réaction de transfert de quatre électrons avec une cinétique lente, [ils] fonctionnent généralement mieux dans une solution alcaline. Il était essentiel de rechercher des électrocatalyseurs à base de métaux non nobles avec d'excellentes performances bifonctionnelles dans [un] électrolyte alcalin", a déclaré Soie. L'équipe a créé l'alliage et le phosphure métallique pour maintenir l'intégrité du catalyseur dans ces conditions alcalines.
Pour tester la composition et l'état de valence du catalyseur NiFeMo-P-C généré, l'équipe a soumis le composé à une mesure par spectroscopie photoélectronique à rayons X (XPS) pour confirmer la présence de Ni, Fe, Mo, P, C et O. Le spectre de résolution du nickel a également identifié les orbites de spin 2p3/2 et 2p1/2, qui font référence à l'état des électrons dans les atomes de nickel du catalyseur.
Dans l'ensemble, l'électrocatalyseur NiFeMo-P-C nouvellement développé nécessite de très faibles surtensions, ou énergie nécessaire pour diviser l'eau, pour HER (87 mV pour atteindre une densité de courant de 10 mA·cm –2 ) et OER (196 mV pour atteindre une densité de courant de 10 mA·cm –2 ). La tension de cellule, ou la différence de tension entre deux électrodes, requise pour l'électrolyse de l'eau à l'aide du catalyseur n'est également que de 1,50 V à 10 mA·cm –2 . .
L’équipe est optimiste quant au fait que leur découverte fera de la production d’hydrogène propre une réalité. "Contrairement à la plupart des catalyseurs bifonctionnels, le NiFeMo-P-C peut atteindre d'excellentes performances catalytiques sans étapes de préparation compliquées ni nanostructures élaborées. En outre, sa durabilité supérieure sans aucune atténuation [de tension] en 50 heures... fait du NiFeMo-P-C un métal non précieux idéal. catalyseur] candidat… pour la production d'hydrogène à grande échelle", a déclaré Tang.
Parmi les autres contributeurs figurent Xiangyang Zhou, Tingting Yang, Ting Li, Youju Zi, Sijing Zhang, Lei Yang, Yingkang Liu et Juan Yang de l'École de métallurgie et d'environnement de l'Université Central South à Changsha, en Chine.
Plus d'informations : Xiangyang Zhou et al, Fabrication in situ d'un composé de carbone NiFeMo-P ancré sur une mousse de nickel comme catalyseur bifonctionnel pour stimuler la division globale de l'eau, Nano Research Energy (2023). DOI :10.26599/NRE.2023.9120086
Fourni par Tsinghua University Press