La barrière hémato-encéphalique bloque l’entrée des anticorps dans le cerveau. Cela limite l'utilisation potentielle d'anticorps thérapeutiques pour traiter les maladies cérébrales, telles que les tumeurs cérébrales.
Ailleurs dans le corps, plus de 100 anticorps thérapeutiques approuvés par la Food and Drug Administration des États-Unis sont utilisés par les équipes médicales pour traiter les cancers et les maladies auto-immunes, infectieuses et métaboliques. Trouver des moyens de transporter les anticorps thérapeutiques à travers la barrière hémato-encéphalique, depuis la circulation sanguine périphérique jusqu'au système nerveux central, pourrait créer des traitements efficaces agissant dans le cerveau.
Dans une nouvelle étude publiée dans la revue Frontiers in Cell and Developmental Biology , des chercheurs de l'Université d'Alabama à Birmingham rapportent que l'ajout dirigé sur site d'un polymère biodégradable approuvé par la FDA au niveau des régions charnières et proches de la charnière de l'anticorps thérapeutique trastuzumab a effectivement facilité l'administration cérébrale de cet anticorps IgG1 monoclonal humain. Le trastuzumab est utilisé pour traiter le cancer du sein et plusieurs autres cancers.
Les travaux préliminaires sur cette nouvelle plateforme comprenaient des expériences in vitro et sur des modèles murins. Les chercheurs affirment que le système d'administration doit encore être optimisé et testé davantage, mais notent que leur méthodologie simple convertit les anticorps thérapeutiques en une forme délivrée par le cerveau qui maintient la fonctionnalité médicale de l'anticorps.
"Les inquiétudes concernant l'entrée dans le cerveau hantent le développement d'anticorps thérapeutiques ciblant les maladies cérébrales, empêchant les traductions médicales des anticorps générés en laboratoire dans les pratiques cliniques", a déclaré Masakazu Kamata, Ph.D., responsable de l'étude et professeur agrégé. au Département de Microbiologie de l'UAB. "Dans ce contexte, cette méthodologie simple a un grand potentiel pour servir de plate-forme non seulement pour réutiliser les anticorps thérapeutiques actuels, mais également pour encourager la conception de nouveaux anticorps pour le traitement des maladies cérébrales."
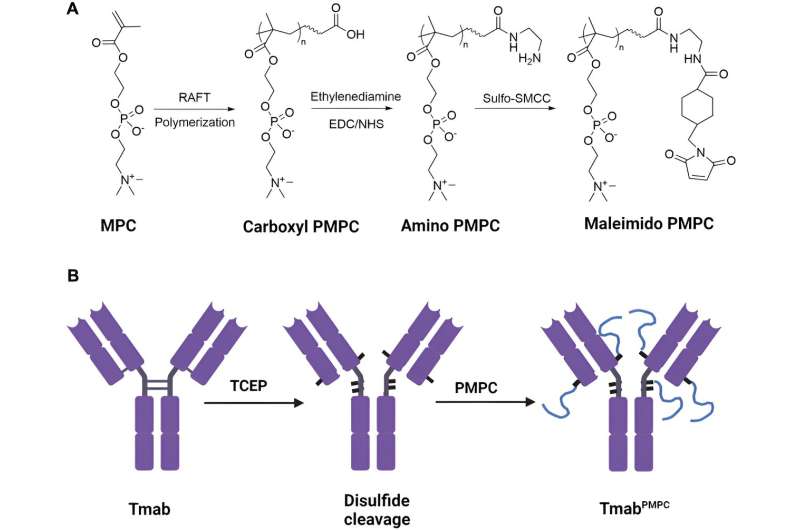
Le polymère biocompatible utilisé était la poly 2-méthacryloyloxyéthylphosphorylcholine, ou PMPC, avec des longueurs de chaîne de 50, 100 ou 200 monomères. Les chercheurs avaient déjà découvert que ce polymère non immunogène, que la FDA a approuvé comme matériau de revêtement pour les dispositifs transplantables, pouvait se lier à deux récepteurs situés sur les cellules endothéliales microvasculaires du cerveau composant la barrière hémato-encéphalique, et que ces cellules pouvaient alors déplacer le polymère. à travers la barrière hémato-encéphalique par transcytose. La transcytose est un transport spécialisé par lequel une cargaison extracellulaire est amenée à l'intérieur de la cellule, transportée à travers le cytoplasme jusqu'à l'autre côté de la cellule, puis libérée.
Les chercheurs de l'UAB ont pu cliver quatre liaisons disulfure interchaînes dans la charnière du trastuzumab IgG1 et dans les régions proches de la charnière, créant ainsi des groupes thiol. Chaque groupe thiol a ensuite été conjugué à une chaîne du PMPC pour créer des molécules de trastuzumab avec l'une des trois longueurs de chaîne, qu'ils ont désignées comme Tmab-PMPC50, Tmab-PMPC100 et Tmab-PMPC200.
Chacun de ces anticorps modifiés maintenait toujours la liaison spécifique du trastuzumab aux cellules exprimant l'antigène HER2, la cible du trastuzumab. Le Tmab-PMPC50 et le Tmab-PMPC100 ont été internalisés dans des cellules HER2-positives et ont favorisé la mort cellulaire dépendante des anticorps, qui est la fonctionnalité médicale par laquelle le trastuzumab tue les cellules du cancer du sein HER2+.
Les chercheurs ont ensuite montré que la conjugaison PMPC du trastuzumab améliorait la pénétration de la barrière hémato-encéphalique à travers les cellules épithéliales de la barrière hémato-encéphalique via la voie de transcytose. Le Tmab-PMPC100 translocable était le meilleur pour pénétrer efficacement la barrière hémato-encéphalique tout en conservant la reconnaissance de l'épitope du trastuzumab, la capacité de l'anticorps à se lier à sa cible antigénique.
Dans un modèle murin, Tmab-PMPC100 et Tmab-PMPC200 étaient environ cinq fois meilleurs en termes de pénétration cérébrale que le trastuzumab natif. Dans des expériences préliminaires in vitro et sur des modèles murins, le trastuzumab modifié par un polymère n'a pas induit de neurotoxicité, n'a pas montré d'effets indésirables sur le foie et n'a pas perturbé l'intégrité de la barrière hémato-encéphalique.
"Ces résultats indiquent collectivement que la conjugaison PMPC permet une délivrance efficace au cerveau d'anticorps thérapeutiques, tels que le trastuzumab, sans induction d'effets indésirables, au moins dans le foie, la barrière hémato-encéphalique ou le cerveau", a déclaré Kamata.
D'autres ont également étudié les moyens de faire passer des anticorps de type cargo à travers la barrière hémato-encéphalique, ont noté les chercheurs.
Dans les travaux qui ont conduit à l'étude actuelle, les chercheurs de l'UAB ont montré qu'ils pouvaient envelopper diverses cargaisons macromoléculaires dans des coques PMPC, et ces nanocapsules ont démontré une circulation sanguine prolongée, une immunogénicité réduite et une amélioration de l'administration cérébrale chez les souris et les primates non humains.
Mais ce système présentait des inconvénients. Les nanocapsules nécessitaient l'ajout de ligands de ciblage pour les amener à leur cible pathologique et d'agents de réticulation dégradables qui permettraient la libération de la cargaison sur ce site. Malheureusement, les microenvironnements associés aux maladies manquent souvent de conditions susceptibles de déclencher la dégradation des agents de réticulation.
D'autres chercheurs cherchant à briser la barrière hémato-encéphalique ont étudié divers ligands autres que le PMPC pour stimuler le transport, tels que des ligands dérivés de microbes et de toxines, ou des protéines endogènes comme les lipoprotéines. Ceux-ci ont généralement des propriétés de surface indésirables, telles qu'être hautement immunogènes, hautement hydrophobes ou chargés. PMPC ne présente pas ces traits indésirables.
Les co-auteurs avec Kamata dans l'étude « Conjugaison orientée site de poly (2-méthacryloyloxyéthyl phosphorylcholine) pour une délivrance améliorée d'anticorps au cerveau » sont Jie Ren, Chloe E. Jepson, Charles J. Kuhlmann, Stella Uloma Azolibe et Madison T. . Blucas, Département de microbiologie de l'UAB ; Sarah L. Nealy et Eugenia Kharlampieva, Département de chimie de l'UAB ; Satoru Osuka, département de neurochirurgie de l'UAB ; et Yoshiko Nagaoka-Kamata, département de pathologie de l'UAB.
Plus d'informations : Jie Ren et al, Conjugaison orientée site de poly(2-méthacryloyloxyéthylphosphorylcholine) pour une délivrance améliorée d'anticorps au cerveau, Frontières de la biologie cellulaire et du développement (2023). DOI : 10.3389/fcell.2023.1214118
Fourni par l'Université d'Alabama à Birmingham