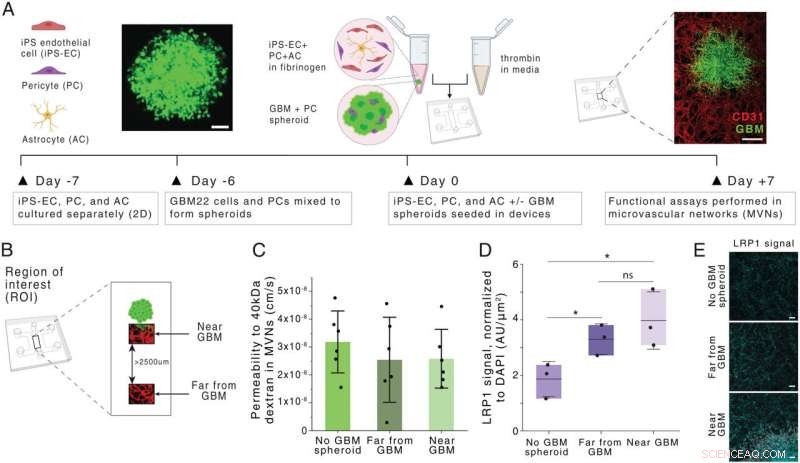
Génération et caractérisation d'un modèle de glioblastome BBB MVN (modèle BBB-GBM). (A) Schéma de la formation de BBB-GBM dans un dispositif microfluidique. (Barres d'échelle :100 µm [gauche] et 500 µm [droite].) (B) ROI identifié spatialement dans le modèle BBB-GBM, avec loin des ROI GBM identifiés comme étant à au moins 2 500 µm du sphéroïde GBM. (C) Perméabilité au dextrane de 40 kDa dans les réseaux vasculaires à travers différents emplacements de retour sur investissement ; chaque point représente n =1 appareil. (D) Expression de LRP1 sur différents sites de retour sur investissement, telle qu'évaluée par coloration par immunofluorescence ; chaque point représente n =1 appareil. (E) Micrographies représentatives de la coloration LRP1 quantifiées en D. (Barres d'échelle :100 µm.) Dans tous les graphiques, les barres représentent la moyenne ± SD. ns, non significatif. *P <0,05. Les analyses statistiques sont décrites dans Matériels et Méthodes. AU, unités arbitraires ; 2D, bidimensionnel. Crédit :Actes de l'Académie nationale des sciences (2022). DOI :10.1073/pnas.2118697119
Il existe actuellement peu de bonnes options de traitement pour le glioblastome, un type agressif de cancer du cerveau avec un taux de mortalité élevé. L'une des raisons pour lesquelles la maladie est si difficile à traiter est que la plupart des agents chimiothérapeutiques ne peuvent pas pénétrer dans les vaisseaux sanguins qui entourent le cerveau.
Une équipe de chercheurs du MIT développe actuellement des nanoparticules porteuses de médicaments qui semblent pénétrer dans le cerveau plus efficacement que les médicaments administrés seuls. À l'aide d'un modèle de tissu humain qu'ils ont conçu, qui reproduit avec précision la barrière hémato-encéphalique, les chercheurs ont montré que les particules pouvaient pénétrer dans les tumeurs et tuer les cellules de glioblastome.
De nombreux traitements potentiels du glioblastome ont montré du succès dans des modèles animaux, mais ont ensuite échoué dans les essais cliniques. Cela suggère qu'un meilleur type de modélisation est nécessaire, déclare Joelle Straehla, chercheuse clinique de Charles W. et Jennifer C. Johnson au Koch Institute for Integrative Cancer Research du MIT, enseignante à la Harvard Medical School et oncologue pédiatrique à Dana-Farber. Institut du cancer.
"Nous espérons qu'en testant ces nanoparticules dans un modèle beaucoup plus réaliste, nous pourrons réduire le temps et l'énergie perdus à essayer des choses en clinique qui ne fonctionnent pas", dit-elle. "Malheureusement, pour ce type de tumeur cérébrale, il y a eu des centaines d'essais qui ont eu des résultats négatifs."
Straehla et Cynthia Hajal, post-doctorante à Dana-Farber, sont les principaux auteurs de l'étude, qui paraît cette semaine dans les Proceedings of the National Academy of Sciences . Paula Hammond, professeure à l'Institut MIT, chef du Département de génie chimique et membre de l'Institut Koch ; et Roger Kamm, professeur émérite Cecil et Ida Green de génie biologique et mécanique, sont les auteurs principaux de l'article.
Modélisation de la barrière hémato-encéphalique
Il y a plusieurs années, le laboratoire de Kamm a commencé à travailler sur un modèle microfluidique du cerveau et des vaisseaux sanguins qui composent la barrière hémato-encéphalique.
Parce que le cerveau est un organe vital, les vaisseaux sanguins entourant le cerveau sont beaucoup plus restrictifs que les autres vaisseaux sanguins du corps, pour empêcher les molécules potentiellement nocives.
Pour imiter cette structure dans un modèle tissulaire, les chercheurs ont cultivé des cellules de glioblastome dérivées de patients dans un dispositif microfluidique. Ensuite, ils ont utilisé des cellules endothéliales humaines pour faire croître des vaisseaux sanguins dans de minuscules tubes entourant la sphère des cellules tumorales. Le modèle comprend également des péricytes et des astrocytes, deux types de cellules impliquées dans le transport de molécules à travers la barrière hémato-encéphalique.
Alors que Hajal travaillait sur ce modèle en tant qu'étudiante diplômée dans le laboratoire de Kamm, elle s'est mise en contact avec Straehla, alors postdoctorale dans le laboratoire de Hammond, qui souhaitait trouver de nouvelles façons de modéliser l'administration de nanoparticules de médicaments au cerveau. Faire passer les médicaments à travers la barrière hémato-encéphalique est essentiel pour améliorer le traitement du glioblastome, qui est généralement traité par une combinaison de chirurgie, de radiothérapie et de témozolomide de chimiothérapie orale. Le taux de survie à cinq ans de la maladie est inférieur à 10 %.
Le laboratoire de Hammond a été le pionnier d'une technique appelée assemblage couche par couche, qu'ils peuvent utiliser pour créer des nanoparticules fonctionnalisées en surface qui transportent des médicaments dans leur noyau. Les particules que les chercheurs ont développées pour cette étude sont recouvertes d'un peptide appelé AP2, qui a été montré dans des travaux antérieurs pour aider les nanoparticules à traverser la barrière hémato-encéphalique. Cependant, sans modèles précis, il était difficile d'étudier comment les peptides contribuaient au transport à travers les vaisseaux sanguins et dans les cellules tumorales.
Lorsque les chercheurs ont livré ces nanoparticules à des modèles tissulaires de glioblastome et de tissu cérébral sain, ils ont découvert que les particules recouvertes du peptide AP2 pénétraient bien mieux les vaisseaux entourant les tumeurs. Ils ont également montré que le transport était dû à la liaison d'un récepteur appelé LRP1, qui est plus abondant près des tumeurs que dans les vaisseaux cérébraux normaux.
Les chercheurs ont ensuite rempli les particules de cisplatine, un médicament de chimiothérapie couramment utilisé. Lorsque ces particules ont été recouvertes du peptide de ciblage, elles ont pu tuer efficacement les cellules tumorales du glioblastome dans le modèle tissulaire. Cependant, les particules qui ne contenaient pas les peptides ont fini par endommager les vaisseaux sanguins sains au lieu de cibler les tumeurs.
"Nous avons constaté une augmentation de la mort cellulaire dans les tumeurs traitées avec la nanoparticule enrobée de peptide par rapport aux nanoparticules nues ou au médicament libre. Ces particules enrobées ont montré une plus grande spécificité pour tuer la tumeur, par rapport à tout tuer de manière non spécifique", déclare Hajal.
Des particules plus efficaces
Les chercheurs ont ensuite essayé de délivrer les nanoparticules à des souris, en utilisant un microscope chirurgical spécialisé pour suivre les nanoparticules se déplaçant dans le cerveau. Ils ont découvert que la capacité des particules à traverser la barrière hémato-encéphalique était très similaire à ce qu'ils avaient observé dans leur modèle de tissu humain.
Ils ont également montré que les nanoparticules enrobées portant du cisplatine pouvaient ralentir la croissance tumorale chez la souris, mais l'effet n'était pas aussi fort que ce qu'ils ont vu dans le modèle tissulaire. Cela pourrait être dû au fait que les tumeurs étaient à un stade plus avancé, selon les chercheurs. Ils espèrent maintenant tester d'autres médicaments, portés par une variété de nanoparticules, pour voir lequel pourrait avoir le plus grand effet. Ils prévoient également d'utiliser leur approche pour modéliser d'autres types de tumeurs cérébrales.
"C'est un modèle que nous pourrions utiliser pour concevoir des nanoparticules plus efficaces", explique Straehla. "Nous n'avons testé qu'un seul type de tumeur cérébrale, mais nous voulons vraiment étendre et tester cela avec beaucoup d'autres, en particulier les tumeurs rares qui sont difficiles à étudier car il n'y a peut-être pas autant d'échantillons disponibles."
Les chercheurs ont décrit la méthode qu'ils ont utilisée pour créer le modèle de tissu cérébral dans un récent Nature Protocols papier, afin que d'autres laboratoires puissent également l'utiliser.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche, de l'innovation et de l'enseignement du MIT. Une nanoparticule et un inhibiteur déclenchent le système immunitaire, déjouant ainsi le cancer du cerveau