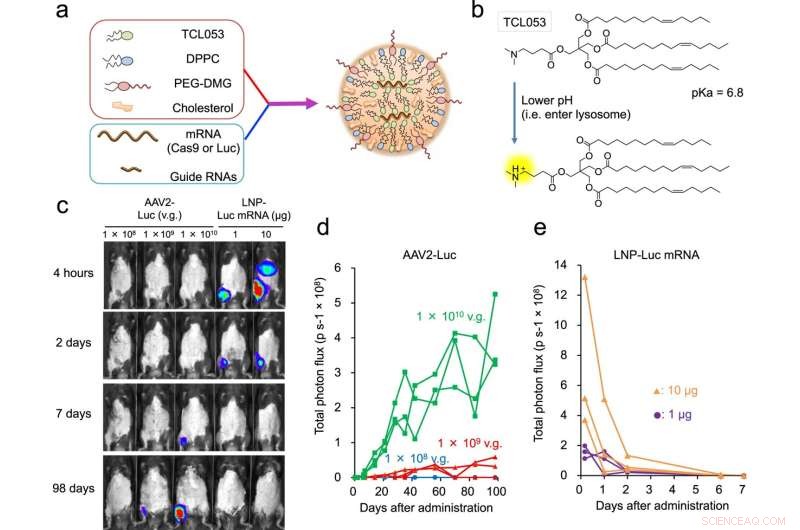
Fig. 1 :Livraison de Luc-ARNm ou CRISPR-Cas9 ARNm/ARNg dans le tissu musculaire. a Illustration schématique de LNP-CRISPR. L'ARNm Luc ou l'ARNm / sg Cas9 est encapsulé dans du LNP composé de TCL053, de DPPC (dipalmitoylphosphatidylcholine), de PEG-DMG (polyéthylène glycol-dimyristoyl glycérol) et de cholestérol. b Structure chimique du lipide ionisable nouvellement synthétisé, TCL053. c Images de bioluminescence représentatives de souris C57BL/6J après l'injection intramusculaire d'AAV2-Luc (1 × 108, 1 × 109 ou 1 × 1010 vg, génomes de vecteur) ou LNP-Luc ARNm (1 ou 10 μg ARNm). d, e Quantification du signal de bioluminescence dans le muscle squelettique de souris C57BL/6J traitées avec l'ARNm AAV2-Luc (d) ou LNP-Luc (e). Les mêmes souris (n = 3 souris par groupe) ont été examinées à plusieurs reprises dans le temps. Les données de flux total (p s−1, photons par seconde) sont tracées sur une seule ligne par souris. Crédit :DOI :10.1038/s41467-021-26714-w
De nombreuses maladies incurables sont le résultat d'une mutation génétique. La technologie d'édition du génome promet de corriger la mutation et donc de nouveaux traitements pour les patients. Cependant, faire parvenir la technologie aux cellules qui ont besoin de la correction reste un défi majeur. Une nouvelle étude dirigée par le professeur agrégé junior CiRA Akitsu Hotta et en collaboration avec Takeda Pharmaceutical Company Limited dans le cadre du programme de recherche conjoint T-CiRA rapporte comment les nanoparticules lipidiques fournissent un moyen efficace d'administration pour traiter la dystrophie musculaire de Duchenne (DMD) chez la souris .
Le prix Nobel de chimie décerné l'année dernière aux découvreurs de CRISPR-Cas9 a cimenté l'impact de la technologie d'édition du génome. Alors que CRISPR-Cas9 peut être appliqué à l'agriculture et à l'élevage pour des aliments plus nutritifs et des cultures robustes, la plupart de l'attention des médias est sur son potentiel médical. La DMD n'est qu'une des nombreuses maladies pour lesquelles les chercheurs envisagent un traitement utilisant CRISPR-Cas9.
"Les médicaments oligonucléotidiques sont désormais disponibles pour la DMD, mais leurs effets sont transitoires, de sorte que le patient doit subir des traitements hebdomadaires. D'autre part, les effets CRISPR-Cas9 durent longtemps", a déclaré Hotta.
La DMD entraîne une atrophie musculaire progressive dans tout le corps. Les patients commencent normalement à présenter des symptômes, tels que des chutes faciles et une incapacité à courir avant l'âge scolaire, et sont souvent sous respirateur avant l'âge adulte.
Pour une maladie comme la DMD, il est nécessaire de cibler un large éventail de muscles squelettiques, ce qui signifie que des injections multiples sont importantes. Les systèmes de délivrance actuellement étudiés utilisent des virus non pathogènes pour délivrer CRISPR-Cas9, mais ces virus induisent des réactions immunitaires et la production d'anticorps, qui interdisent les injections multiples.
Les nanoparticules lipidiques peuvent empêcher ces réactions. Comme leur nom l'indique, les nanoparticules lipidiques sont de minuscules particules de moins de 0,1 µm de diamètre et constituées de lipides qui modifient leurs propriétés en réponse à l'acidité. Cette caractéristique leur permet de rester intacts à l'extérieur de la cellule, mais une fois à l'intérieur, ils se rompent pour libérer leur contenu, tel que CRISPR-Cas9, qui est alors libre de corriger la mutation génétique. Les nanoparticules lipidiques sont utilisées pour les vaccins COVID-19, mais leur utilité pour la thérapie d'édition du génome est toujours à l'étude. Dans le cadre du programme de recherche conjoint T-CiRA, Hotta a développé des nanoparticules lipidiques capables de fournir à la cellule une technologie d'édition du génome.
Après avoir expérimenté plusieurs formulations, l'étude rapporte une nouvelle nanoparticule lipidique qui encapsule CRISPR-Cas9 à l'intérieur et cible les cellules musculaires chez la souris.
Contrairement aux médicaments oligonucléotidiques, dont les effets chez la souris diminuaient constamment après le traitement et disparaissaient après quelques mois, l'étude montre que l'administration de CRISPR-Cas9 avec la nouvelle nanoparticule lipidique a maintenu un effet constant dans le muscle qui a duré plus d'un an.
De plus, les effets étaient évidents même lors de l'administration des particules avec de multiples injections intramusculaires, alors que l'administration basée sur le virus n'a pas eu d'effet après la deuxième injection. De plus, les nanoparticules lipidiques perfusées par voie intraveineuse dans les membres ont eu un effet thérapeutique sur plusieurs tissus musculaires.
Ajoutant à la sécurité, Hotta a noté, "CRISPR-Cas9 a disparu du corps en quelques jours. Cela signifie que le risque d'édition du génome hors cible est minime, mais les effets thérapeutiques durent longtemps." L'édition de gènes CRISPR/Cas9 améliore l'efficacité de la thérapie par ultrasons contre le cancer