Fig. 1. Les scientifiques tentent depuis longtemps de décoder les sous-structures complexes des protéines. Maintenant, des chercheurs de Tokyo Tech ont enfin fait la lumière sur ce front avec l'étude de l'auto-assemblage de protéines artificielles à l'aide d'aiguilles à protéines. Crédit :Takafumi Ueno de l'Institut de technologie de Tokyo
L'assemblage des protéines est essentiel à la formation de structures biologiques ordonnées, mais imaginez l'ingénierie. C'est exactement ce que les chercheurs de Tokyo Tech ont accompli avec les aiguilles protéinées. En régulant les interactions bout à bout de ces aiguilles, ils ont permis leur auto-assemblage dans des structures en treillis, des états monomères ordonnés et des assemblages de fibres, ouvrant la voie à la construction contrôlée d'un plus grand nombre d'architectures protéiques de ce type.
Les protéines sont les éléments de base de notre corps. Cependant, leurs structures moléculaires et macroscopiques sont complexes et variées, avec de multiples modèles de repliement et sous-structures. Les scientifiques tentent de décoder ces structures depuis un certain temps et de nombreux progrès ont été réalisés grâce à la microscopie à fluorescence (FM), la microscopie à force atomique (AFM) et l'AFM à grande vitesse (HS-AFM). Cependant, ils n'ont pas pu observer directement les mouvements dynamiques des protéines lors de l'assemblage. Cela est principalement dû à la structure complexe des protéines, qui sont trop petites pour être mesurées avec les techniques existantes.
Une équipe collaboratrice de chercheurs de l'Institut de technologie de Tokyo (Tokyo Tech), de l'Université de Kyushu, de l'Université de Nagoya et des Instituts nationaux des sciences naturelles a maintenant développé une aiguille de protéine anisotrope spécialisée (PN) pour aider à déterminer l'assemblage de protéines anisotropes similaires, nous donnant des indices sur leur microstructure et leur assemblage.
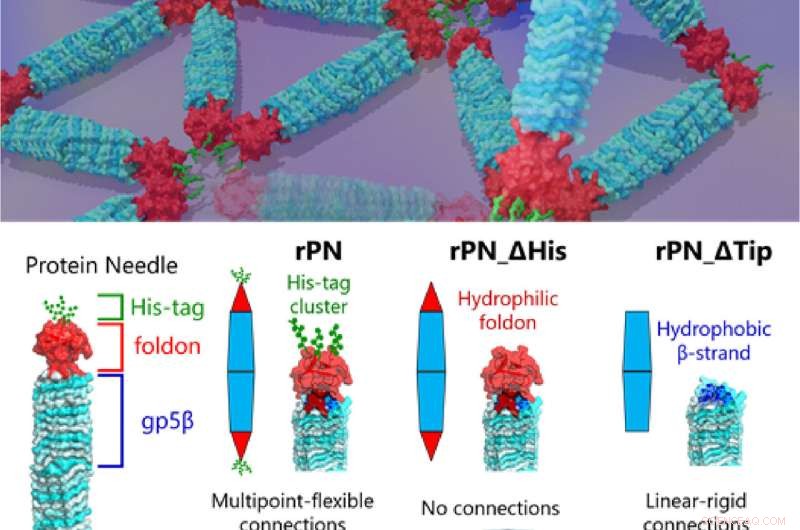
Le professeur Takafumi Ueno de Tokyo Tech, qui a dirigé l'étude, explique les prémisses de leur travail :"Notre PN est une protéine en forme d'aiguille composée du corps rigide (hélice β), de la coiffe terminale (foldon) et d'une liaison motif (étiquette hexa-histidine, His-tag). En modifiant ces PN en supprimant le motif His-tag et le capuchon repliable, nous pouvons produire trois types différents de PN. Cela nous a permis de réguler et d'observer différents modèles d'assemblage et leur évolution. , nous donnant des indices sur la mécanique des différentes interactions protéine-protéine que nous trouvons dans la nature." Les résultats de cette étude ont été publiés dans la revue Small.
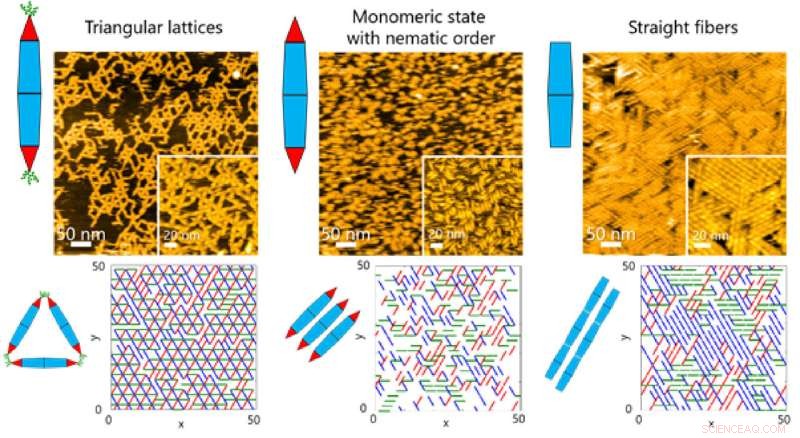
Fig. 2. Les chaînes protéiques de base subissent souvent un auto-assemblage dynamique pour former des structures supramoléculaires complexes. Les scientifiques de Tokyo Tech ont maintenant réussi à explorer la dynamique d'assemblage à l'aide d'aiguilles à protéines modifiées. Crédit :Takafumi Ueno de l'Institut de technologie de Tokyo
En solution, les PN forment spontanément une structure hautement stable d'une longueur d'environ 20 nm et d'une largeur d'environ 3,5 nm, suffisamment petite pour suivre le mouvement de rotation de molécules individuelles tout en étant mécaniquement solide.
Sur les surfaces, l'équipe a observé différents types de structures ordonnées lors de l'auto-assemblage des PN. Ces structures allaient de réseaux triangulaires et d'états monomères d'ordre nématique (orientation unidimensionnelle) à des assemblages de fibres (Figure 1).
Ceci, à son tour, a permis à l'équipe d'étudier les processus dynamiques impliqués dans l'assemblage des protéines grâce à une combinaison de HS-AFM et de simulations (Figure 2). Les résultats ont révélé que la formation de la structure de réseau triangulaire était guidée par les mouvements dynamiques de PN, qui contribuent à la formation de réseaux ordonnés (Figure 3).
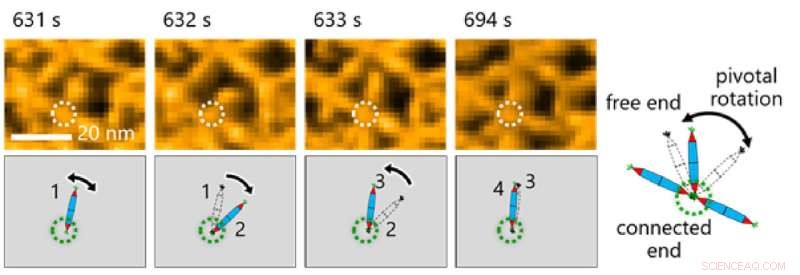
Fig. 3. L'observation du mouvement moléculaire des PN était cruciale pour faire des observations dans cette étude. Ici, les chercheurs ont noté une rotation pivot autour de l'interaction His-tag entre les aiguilles protéiques. Crédit :Takafumi Ueno de l'Institut de technologie de Tokyo
Ces découvertes ont enthousiasmé les chercheurs, qui envisagent ses ramifications potentielles. "Ces molécules jouent un rôle si crucial dans les systèmes biologiques que la compréhension de leur structure ferait avancer le domaine de manière significative. Par exemple, nous pourrions l'utiliser pour jeter les bases de la construction de structures supramoléculaires en concevant les mouvements collectifs dynamiques des protéines. Ce concept peut conduire à l'ingénierie de matériaux en feuilles biocompatibles, de transports ciblés de médicaments et même de nano-robots à base de protéines », explique le professeur Ueno. Encodage des voies d'assemblage hiérarchiques des protéines