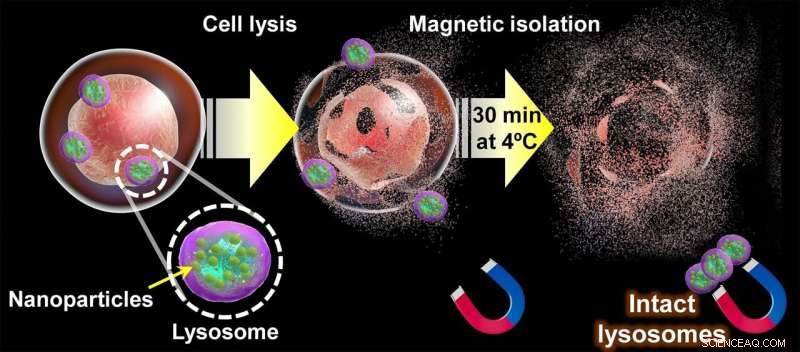
Schéma de l'approche proposée pour extraire les lysosomes intacts. Une fois que les nanoparticules magnétiques se sont naturellement accumulées dans les lysosomes d'une cellule par la voie endocytaire, la membrane cellulaire est rompue. et son contenu « tamisé » pendant 30 minutes à l'aide d'aimants. À la fin de ce processus, des lysosomes intacts peuvent être récupérés des aimants et utilisés pour étudier leur structure, leurs métabolites et leur composition protéique. Crédit :Shinya Maenosono
Le bon fonctionnement des cellules repose sur l'orchestration précise de nombreux processus et organites complexes. Les lysosomes - organites cellulaires vitaux - sont des sous-unités remplies d'enzymes présentes dans de nombreuses cellules animales qui aident à décomposer et à réutiliser les macromolécules, telles que les protéines, les lipides et les nucléotides. Outre leur fonction dans la digestion cellulaire et la gestion des déchets, les lysosomes participent également à la signalisation des acides aminés, qui stimule la synthèse des protéines aux côtés d'autres effets.
Étant donné que de nombreuses maladies sont causées par des défauts de la fonction des lysosomes, il n'est pas surprenant que les chercheurs tentent activement de comprendre ces organites depuis des décennies. Mais seules quelques techniques permettent d'extraire les lysosomes de l'intérieur d'une cellule. La méthode la plus courante est appelée "ultracentrifugation à gradient de densité". Il s'agit de briser doucement la membrane cellulaire et d'appliquer une force centrifuge au contenu de la cellule. Cela sépare les composants cellulaires par densité. Malheureusement, certains autres organites ont la même densité que les lysosomes, ce qui donne des échantillons contenant des impuretés. De plus, le processus prend tellement de temps qu'au moment où il se termine, de nombreuses protéines lysosomales ont déjà été perdues et/ou dégradées.
Une technique plus avancée, appelée "immunoprécipitation", repose sur la modification des protéines de surface des lysosomes afin qu'elles puissent être capturées par des billes magnétiques recouvertes d'anticorps spécialement conçus. Bien que cette approche produise des résultats plus purs, la composition en protéines des lysosomes extraits est modifiée par la procédure et, par conséquent, les analyses de protéines ultérieures peuvent être compromises. Il est donc clair que nous devons trouver un meilleur moyen d'extraire les lysosomes des cellules.
Heureusement, une équipe de scientifiques dirigée par le professeur Shinya Maenosono du Japan Advanced Institute of Science and Technology (JAIST) est intervenue et a développé une nouvelle stratégie pour séparer rapidement les lysosomes intacts avec une grande pureté. Cette étude a été publiée dans ACS Nano et comprenait également le professeur Kazuaki Matsumura et le professeur associé Yuichi Hiratsuka de JAIST, et le professeur Tomohiko Taguchi de l'Université de Tohoku, au Japon.
Leur stratégie est centrée sur l'utilisation de nanoparticules hybrides magnétiques-plasmoniques (MPNP) constituées d'argent et d'un alliage fer-cobalt et recouvertes d'un composé appelé amino dextran (aDxt). La base de cette approche est que les MPNP recouverts d'aDxt sont naturellement ingérés par les cellules par «endocytose», qui culmine à l'intérieur des lysosomes. Une fois que suffisamment de MPNP se sont accumulés à l'intérieur des lysosomes, les cellules peuvent être doucement "écrasées" et les lysosomes récupérés à l'aide d'aimants.
Pour que cette méthode fonctionne, il est essentiel que les MPNP soient situés uniquement dans les lysosomes et non dans d'autres organites. C'est là que l'imagerie plasmon est utile, car la manière distincte dont les nanoparticules plasmoniques interagissent avec la lumière les rend faciles à visualiser avec un microscope optique. En colorant différemment chaque type d'organite de la voie endocytaire à l'aide de l'immunocoloration et en vérifiant comment l'emplacement des MPNP les chevauche, les chercheurs ont déterminé le temps précis nécessaire à la plupart des MPNP pour atteindre les lysosomes. Cela garantit à son tour que le processus de séparation donne des échantillons de lysosomes d'une grande pureté.
Ensuite, l'équipe a analysé les effets de la température et du temps de séparation magnétique sur la composition protéique des lysosomes extraits. Leurs résultats ont montré que la perte de protéines était remarquablement rapide, même à des températures aussi basses que 4°C. Heureusement, leur approche a été suffisamment rapide pour extraire les lysosomes intacts, comme le souligne le professeur Maenosono :"Nous avons constaté que le temps maximal nécessaire pour isoler les lysosomes après la rupture cellulaire était de 30 minutes, ce qui est nettement plus court que le temps requis en utilisant des techniques basées sur la centrifugation, qui nécessitent généralement un temps de séparation minimum de plusieurs heures."
Dans l'ensemble, cette nouvelle technique aidera les chercheurs à explorer les métabolites fragiles des lysosomes et comment ils changent en réponse aux stimuli. À son tour, cela ouvrira la voie à de nouvelles connaissances sur les troubles liés au dysfonctionnement lysosomal. À cet égard, le professeur Maenosono remarque :« Étant donné la relation profonde des lysosomes avec de nombreux métabolites cellulaires, une compréhension plus approfondie de la fonction lysosomale est nécessaire pour déterminer sa régulation dans différents états cellulaires. Par conséquent, notre technique peut contribuer à une meilleure compréhension et un meilleur traitement des maladies lysosomales à l'avenir." De plus, cette nouvelle approche pourrait être modifiée pour extraire d'autres organites que les lysosomes. Espérons que cette étude nous rapprochera de la compréhension du contenu des cellules à un degré beaucoup plus élevé. Les chercheurs réalisent le profilage métabolomique de lysosomes agrandis individuels