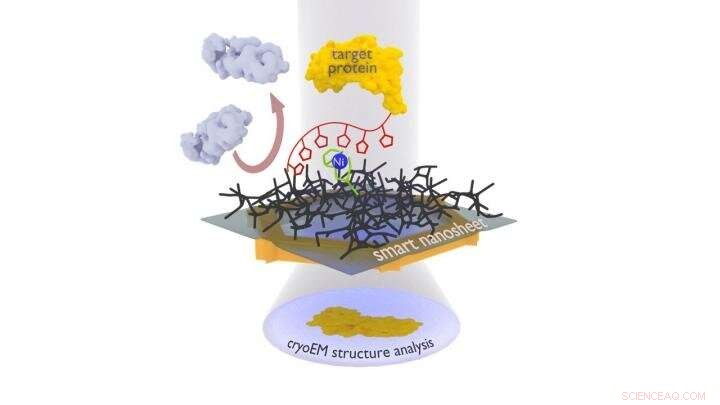
Le complexe protéique à examiner (jaune) est fixé sur la nanofeuillet intelligent via un complexe de nickel à l'aide d'un marqueur (chaîne rouge avec des pentagones). Les protéines indésirables (en gris) sont repoussées par l'hydrogel (grille noire). Après avoir gelé toute la structure, comprenant une fine pellicule d'eau, cela peut être irradié avec des électrons pour obtenir des images des protéines liées, à partir de laquelle un ordinateur peut ensuite calculer la structure 3D de la protéine. Crédit :Andrey Turchanin/Zian Tang
Une équipe interdisciplinaire de Francfort et d'Iéna a développé une sorte d'appât avec lequel pêcher des complexes protéiques à partir de mélanges. Grâce à cet 'appât, ' la protéine souhaitée est disponible beaucoup plus rapidement pour un examen plus approfondi au microscope électronique. L'équipe de recherche a baptisé cette couche innovante de carbone moléculaire ultrafin le « nanofeuillet intelligent ». Avec l'aide de ce nouveau développement, les maladies et leur traitement médicamenteux peuvent être mieux compris, par exemple.
"Avec notre procédé, de nouveaux types de protéines peuvent être isolés de mélanges et caractérisés en une semaine, " explique Daniel Rhinow de l'Institut Max Planck de biophysique de Francfort. " A ce jour, seul l'isolement des protéines faisait souvent partie d'un doctorat de plusieurs années." Avec Andreas Terfort (Université Goethe) et Andrey Turchanin (Université Friedrich Schiller Iéna), l'idée a germé il y a quelques années de pêcher les protéines souhaitées directement dans des mélanges en équipant une nanofeuillet de sites de reconnaissance sur lesquels la protéine cible se lie. Les chercheurs ont maintenant réussi à rendre les protéines directement disponibles pour examen en utilisant la cryo-microscopie électronique à travers une « nanofeuille intelligente ».
La cryo-microscopie électronique est basée sur la congélation-choc d'un échantillon à des températures inférieures à -150 °C. Dans ce processus, la protéine conserve sa structure, aucun agent de fixation et de coloration interférant n'est nécessaire, et les électrons peuvent facilement irradier l'objet gelé. Le résultat est haute résolution, des images tridimensionnelles des plus petites structures, par exemple des virus et de l'ADN, presque à l'échelle d'un atome d'hydrogène.
En préparation, les protéines sont surgelées dans une couche d'eau extrêmement mince sur une grille métallique minuscule. Précédemment, les échantillons devaient être nettoyés au cours d'une procédure complexe, impliquant souvent une perte importante de matière, avant d'être examinés au microscope électronique. La procédure de microscopie électronique n'est efficace que si un seul type de protéine est lié à la couche d'eau.
Le groupe de recherche dirigé par Turchanin utilise désormais des nanofeuillets d'à peine un nanomètre d'épaisseur et composés d'une monocouche moléculaire auto-assemblée réticulée. Le groupe de Terfort enrobe cette nanofeuillet d'un agent gélifiant comme base du mince film d'eau nécessaire à la congélation. Les chercheurs y attachent ensuite des sites de reconnaissance (un groupe acide nitrilotriacétique spécial avec des ions nickel). L'équipe dirigée par Rhinow utilise les nanofeuillets intelligents ainsi traités pour extraire des protéines d'un mélange. Ceux-ci ont été préalablement marqués d'une chaîne histidine avec laquelle ils se lient aux sites de reconnaissance; toutes les autres particules interférentes peuvent être rincées. La nanofeuille avec la protéine liée peut ensuite être examinée directement au microscope électronique.
"Nos nanofeuillets intelligents sont particulièrement efficaces car la couche d'hydrogel stabilise le film mince d'eau requis et supprime en même temps la liaison non spécifique des particules interférentes, " explique Julian Scherr de l'Université Goethe. " De cette façon, la biologie structurale moléculaire peut maintenant examiner les structures et les fonctions des protéines beaucoup plus rapidement. » Les connaissances acquises peuvent être utilisées, par exemple, pour mieux comprendre les maladies et leur traitement médicamenteux.
L'équipe a breveté les nouvelles nanofeuilles et a en outre déjà trouvé un fabricant qui mettra cet outil utile sur le marché.