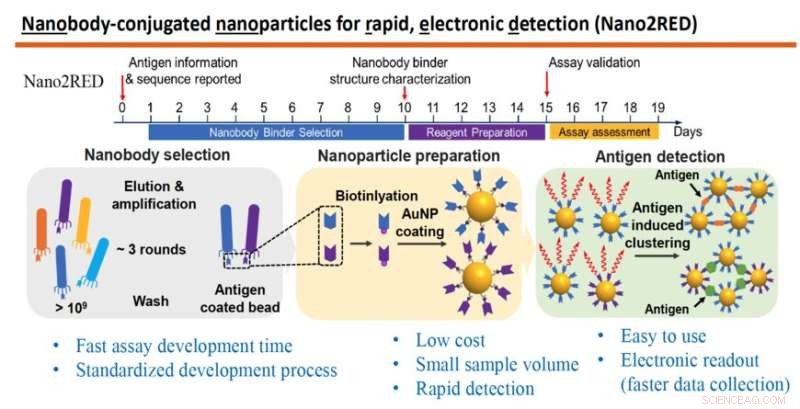
Le graphique met en évidence les principales caractéristiques de Nano2RED, une méthode de diagnostic innovante inventée par le professeur Wang et ses collègues. La partie supérieure illustre la chronologie rapide des étapes de production du test, qui peuvent toutes être réalisées en environ 20 jours. La section centrale du graphique montre les étapes de base impliquées. Tout d'abord, une grande bibliothèque d'anticorps synthétiques ou de nanocorps est produite et criblée contre un antigène connu (à gauche), ensuite, les nanocorps sont attachés aux nanoparticules d'or (au milieu) et enfin, les antigènes de la maladie sont détectés dans un échantillon lorsque les nanocorps liés aux nanoparticules d'or fusionnent avec eux, produisant un résultat de test positif, (à droite). Crédit :laboratoire Wang
Ces dernières années, des maladies infectieuses mortelles, dont Ebola et COVID-19, sont apparues et ont provoqué une dévastation humaine généralisée. Bien que les chercheurs aient développé une gamme de méthodes sophistiquées pour détecter de telles infections, les diagnostics existants sont confrontés à de nombreuses limitations.
Dans une nouvelle étude, Chao Wang, chercheur au Biodesign Institute and School of Electrical, Computer &Energy Engineering de l'Arizona State University, ainsi que des collègues et collaborateurs de l'ASU à l'Université de Washington (UW), Seattle, décrivent une nouvelle méthode pour détecter des virus comme Virus Ebola (EBOV) et SARS CoV-2.
La technique, connue sous le nom de Nano2RED, est une variante intelligente des tests conventionnels de haute précision reposant sur des protocoles de test complexes et des systèmes de lecture coûteux. Les nanocapteurs en solution ("Nano2" dans le nom) servent à détecter les antigènes pathologiques dans un échantillon par simple mélange. Le processus innovant de lecture rapide et électronique ("RED") développé dans le laboratoire Wang fournit des résultats de test, qui sont détectables sous la forme d'un changement de couleur dans la solution d'échantillon, et enregistrent les données via des éléments semi-conducteurs peu coûteux tels que des LED et des photodétecteurs.
La technologie représente une avancée significative dans la lutte contre les maladies infectieuses. Il peut être développé et produit à très faible coût, déployé quelques semaines ou jours après une épidémie, et mis à disposition pour environ 1 centime par test.
Comparé aux tests de laboratoire de haute précision largement utilisés, tels que ELISA, Nano2RED est beaucoup plus facile à utiliser. Il ne nécessite pas d'incubation ou de lavage de surface, de marquage par colorant ou d'amplification, tout en offrant une sensibilité environ 10 fois supérieure à celle d'ELISA. De plus, l'utilisation de dispositifs à semi-conducteurs prend en charge un système de lecture numérique hautement portable, qui peut être développé et produit à un coût aussi bas que quelques dollars, ce qui le rend idéal non seulement pour une utilisation en laboratoire mais aussi pour les cliniques, l'utilisation à domicile et à distance ou endroits aux ressources limitées. Cette approche est basée sur des conceptions modulaires et pourrait potentiellement être utilisée pour tester n'importe quel agent pathogène.
"Cette technologie ne fonctionne pas parce qu'elle est complexe mais parce qu'elle est simple", explique le professeur Wang. "Une autre caractéristique unique est la nature multidisciplinaire de la biodétection. Une compréhension fondamentale de la biochimie, de la fluidique et de l'optoélectronique nous a aidés à proposer quelque chose d'aussi "simple"."
Wang est chercheur au Biodesign Center for Molecular Design and Biomimetics de l'ASU. Il est également chercheur à la School of Electrical, Computer and Energy Engineering de l'ASU; et le Centre d'innovation photonique. Le Dr Liangcai Gu est collaborateur au Département de biochimie et à l'Institut de conception des protéines de l'UW, Seattle.
La recherche apparaît dans le numéro actuel de la revue Biosensors and Bioelectronics . Le Dr Xiahui Chen et Md Ashif Ikbal de l'ASU et le Dr Shoukai Kang de l'UW sont les premiers auteurs, et Jiawei Zuo et Yuxin Pan sont les autres auteurs contributeurs.
Le goulot d'étranglement des tests
Les épidémiologistes connaissent depuis longtemps la formule de base lorsqu'ils sont confrontés à une épidémie. Pour identifier les cas et arrêter la contagion, il est nécessaire de développer un test ou un dosage précis qui puisse identifier la maladie, puis de tester tôt et souvent, pour évaluer le taux de propagation et tenter d'isoler les personnes infectées.
Malheureusement, au moment où un nouveau diagnostic a été développé, fabriqué et distribué, l'épidémie de la maladie est souvent déjà largement répandue et difficile à contenir. De plus, des tests précis, y compris la PCR (qui peut amplifier de minuscules niveaux d'acides nucléiques pathogènes à des niveaux mesurables), sont souvent coûteux, à forte intensité de main-d'œuvre et nécessitent des installations de laboratoire sophistiquées.
L'épidémie d'Ebola de 2014-2016, bien que largement confinée à l'Afrique de l'Ouest, s'est propagée à une vitesse terrifiante, provoquant la panique et tuant plus de 11 000 personnes. Le taux de létalité du virus, l'un des plus élevés de tous les agents pathogènes connus, peut dépasser 90 %, selon la souche de la maladie. La crise a été exacerbée par une combinaison de systèmes de surveillance inadéquats et de mauvaises infrastructures de santé publique.
Le SRAS CoV-2, bien que moins mortel qu'Ebola, s'est propagé dans tous les pays du monde et a déjà tué plus de 5,6 millions de personnes dans le monde. Dans les deux épidémies, les tests de diagnostic sont arrivés tardivement sur les lieux. De plus, les exigences de test coûteuses et lourdes ont fait que trop peu de tests ont été administrés, même après leur développement réussi.
La nouvelle étude applique sa méthode innovante pour tester ces deux maladies importantes comme preuve de concept.
raz-de-marée
Une caractéristique commune à de nombreuses épidémies est la vitesse fulgurante avec laquelle un agent pathogène, après avoir d'abord infecté une poignée de personnes, peut prendre de l'ampleur, se propager dans toutes les directions et submerger rapidement les hôpitaux et les prestataires de soins de santé. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." Development of home COVID-19 test comparable to PCR accuracy, selectivity