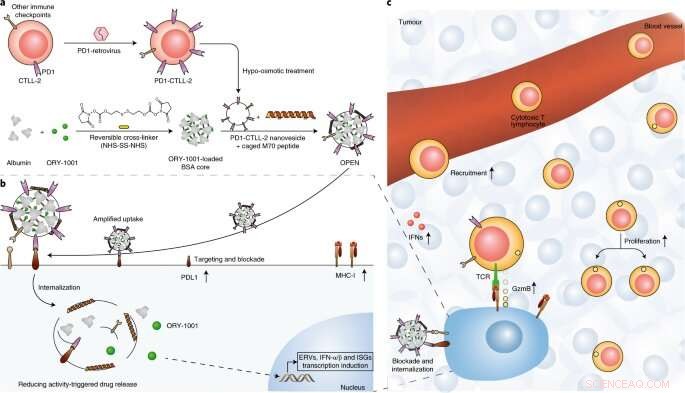
Fig. 1 :Illustration schématique de la préparation et du mécanisme d'action d'OPEN. Crédit :DOI :10.1038/s41565-021-00972-7
L'immunothérapie anticancéreuse telle que le blocage des points de contrôle immunitaire (ICB) est un traitement révolutionnaire contre les tumeurs en renforçant la surveillance immunitaire et même en induisant un contrôle à long terme de la maladie.
Les interférons de type I (IFN) sont des coordinateurs clés de l'interaction tumeur-système immunitaire. La signalisation IFN altérée est associée à un mauvais pronostic chez les patients atteints de cancer du côlon, mélanome, cancer du sein triple négatif, etc. La thérapie complémentaire actuelle à l'IFN entraîne parfois des effets secondaires graves et un programme de résistance multigénique induit par l'IFN à l'ICB.
Dans une étude publiée dans Nature Nanotechnologie , une équipe de recherche dirigée par Li Yaping et Zhang Pengcheng du Shanghai Institute of Materia Medica de l'Académie chinoise des sciences (CAS) a démontré que les effets paradoxaux de la thérapie supplémentaire par IFN pouvaient être traités à l'aide d'un nanoinducteur épigénétique d'IFN décoré d'une membrane de lymphocytes T (OPEN ).
Les chercheurs ont d'abord modifié génétiquement une lignée de cellules T cytotoxiques surexprimant le récepteur de mort programmée 1 (PD1), puis utilisé la membrane de ces cellules pour envelopper une nanoparticule de protéine chargée en ORY-1001, un inhibiteur de l'histone déméthylase 1 spécifique de la lysine (LSD1), pour créer OUVERT.
Ils ont révélé que l'OPEN améliorait l'accumulation intratumorale d'ORY-1001 et la production locale d'IFN après administration intraveineuse, et a démontré que les IFN augmentaient l'infiltration tumorale, la prolifération et l'activité des cellules T cytotoxiques spécifiques de la tumeur et la présentation de l'antigène des cellules tumorales.
Outre, ils ont prouvé que le ligand de mort programmée 1 (PDL1) induit par l'IFN et d'autres molécules de point de contrôle immunitaire étaient facilement neutralisés par OPEN ultérieur. Ce processus séquentiel a spécifiquement reconstitué les IFN intratumoraux et a atténué l'évasion immunitaire induite par l'IFN, et retardant ainsi la croissance tumorale dans plusieurs modèles de tumeurs.
"L'étude démontre une stratégie élégante pour résoudre les effets paradoxaux de la thérapie complémentaire d'IFN à l'aide de nano-inducteurs épigénétiques d'IFN. Il s'agit d'une étape importante dans le domaine de la nanomédecine pour une immunothérapie anticancéreuse plus sûre et plus efficace, " a déclaré le professeur Zhao Yuliang, un académicien du CAS.
"Il s'agit de la première recherche qui élabore le grand potentiel de la nanomédecine épigénétique dans l'immunothérapie du cancer. La nanomédecine a une valeur de traduction clinique significative en raison de ses avantages dans l'administration ciblée des tumeurs et le blocage des points de contrôle immunitaires, " a déclaré le professeur Hao Xishan, un académicien de l'Académie chinoise d'ingénierie (CAE).