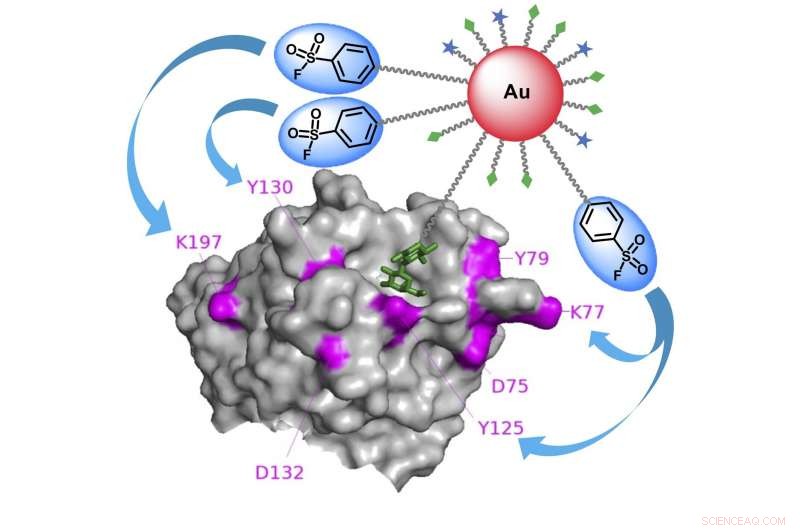
Résumé graphique que l'étiquetage d'affinité à base de nanoparticules d'or pour identifier des protéines spécifiques de liaison aux glucides. Crédit :Kaori Sakurai/TUAT
Les cellules jouent un jeu précis de téléphone, s'envoyer des messages qui déclenchent des actions plus loin. Avec une signalisation claire, les cellules atteignent leurs objectifs. Dans la maladie, cependant, les signaux se brisent et entraînent des messages confus et des conséquences imprévues. Pour aider à analyser ces signaux et comment ils fonctionnent dans le domaine de la santé, et de manière erronée dans la maladie, les scientifiques étiquettent les protéines avec des étiquettes qu'ils peuvent suivre au fur et à mesure que les protéines interagissent avec le monde moléculaire qui les entoure.
Le défi consiste à déterminer quelles protéines marquer en premier lieu. Maintenant, une équipe dirigée par des chercheurs de l'Université d'agriculture et de technologie de Tokyo (TUAT) a développé une nouvelle approche pour identifier et marquer les protéines spécifiques. Ils ont publié leurs résultats le 1er juin dans Angewandte Chemie .
"Nous sommes intéressés à explorer les récepteurs protéiques de certaines molécules glucidiques impliquées dans la médiation de la signalisation cellulaire, en particulier dans les cellules cancéreuses, " a déclaré l'auteur de l'article Kaori Sakurai, professeur agrégé au Département de biotechnologie et des sciences de la vie de la TUAT.
Les molécules glucidiques, appelés ligands, sont typiquement exprimés à la surface des cellules et sont connus pour former dynamiquement des complexes avec des récepteurs protéiques pour coordonner des fonctions cellulaires complexes. Cependant, Sakurai a dit, les protéines responsables de la liaison des glucides ont été difficiles à identifier car elles se lient si faiblement aux molécules.
Les chercheurs ont conçu un nouveau type de sonde glucidique qui non seulement se lierait aux molécules, mais étroitement lié à eux.
"Nous avons utilisé des nanoparticules d'or comme échafaudage pour attacher à la fois des ligands glucidiques et des électrophiles - un produit chimique qui aime réagir avec d'autres molécules - de manière polyvalente, " dit Sakurai. " Par ici, nous avons pu augmenter considérablement l'affinité de liaison et l'efficacité de la réaction envers les protéines de liaison aux glucides."
Les chercheurs ont appliqué les sondes conçues au lysat cellulaire, un fluide contenant les entrailles de cellules brisées.
"Les sondes ont rapidement trouvé les protéines cibles de liaison aux glucides, déclencher la réaction des groupes électrophiles avec des résidus d'acides aminés donneurs d'électrons sur des protéines voisines, " a déclaré Sakurai. " Cela a abouti à des protéines fermement réticulées à la surface des nanoparticules d'or, facilitant par la suite l'analyse de leur identité."
L'équipe a évalué plusieurs groupes électrophiles pour identifier le type le plus efficace pour marquer leurs protéines cibles.
"Nous avons découvert qu'un groupe électrophile particulier appelé fluorure d'aryl sulfonyle est le mieux adapté pour le marquage d'affinité des protéines liant les glucides, " a déclaré le co-auteur Nanako Suto, un étudiant diplômé du Département de biotechnologie et des sciences de la vie de la TUAT. "Toutefois, ils ont rarement été utilisés pour identifier des protéines cibles, probablement parce qu'ils réagiraient de manière non sélective avec divers autres, protéines indésirables."
Cependant, l'ampleur de l'utilisation du fluorure d'aryl sulfonyle semble atténuer le problème.
"La non-sélectivité n'est pas un problème si le fluorure d'aryl sulfonyle est utilisé à de très faibles concentrations, à l'échelle nanométrique, " a déclaré le co-auteur Shione Kamoshita, également étudiant diplômé au Département de biotechnologie et des sciences de la vie, TUAT.
L'échafaudage de nanoparticules d'or affiche de nombreuses copies du groupe électrophile, qui maintient la concentration locale de fluorure d'aryl sulfonyle élevée sur la surface des nanoparticules mais les retient du système cellulaire général et réagit aux protéines indésirables. Avec la forte concentration au niveau nano, certaines copies de groupes électrophiles peuvent réagir efficacement avec des protéines cibles.
« Grâce à ce processus, nous avons pu obtenir un marquage d'affinité hautement efficace et sélectif des protéines de liaison aux glucides dans le lysat cellulaire, " a déclaré Sakurai. " Nous appliquerons la nouvelle méthode à l'identification de cibles de plusieurs ligands glucidiques liés au cancer et étudierons leur fonction dans le développement du cancer. En parallèle, nous visons à explorer l'utilité générale de cette nouvelle conception de sonde pour diverses autres petites molécules bioactives, afin d'accélérer l'élucidation de leurs mécanismes."