Crédit :Unsplash/CC0 Domaine public
Dans le corps humain, les protéines se produisent parfois dans des agrégats fibrillaires appelés amyloïdes. Bien que certains amyloïdes soient connus pour avoir une fonction biologique, la formation d'amyloïde est souvent associée à des pathologies, dont les maladies d'Alzheimer et de Parkinson. Comprendre comment se forment exactement les fibrilles amyloïdes est crucial pour mieux comprendre le développement de ces maladies et pour faire progresser les approches thérapeutiques.
Maintenant, Takahiro Watanabe-Nakayama de l'Université de Kanazawa, Kenjiro Ono de l'Université Showa, et ses collègues ont étudié le processus de formation de fibrilles amyloïdes particulières à l'aide d'une technique permettant de visualiser la croissance au fil du temps. Les scientifiques ont spécifiquement examiné l'effet de l'ensemencement croisé («mélange») de différentes protéines formant des agrégats, et trouvé des variations dans les taux d'allongement et les structures des fibrilles.
Les chercheurs ont étudié l'alpha-synucléine, une protéine abondante dans le cerveau humain. Ils ont examiné ce qui s'est passé en laissant des molécules d'alpha-synucléine de type sauvage - les variante la plus abondante — former des agrégats, et aussi comment l'agrégation est différente lors de l'introduction (ensemencement croisé) de variantes mutantes associées à la maladie de Parkinson. En outre, les scientifiques ont examiné l'influence du niveau de pH du microenvironnement dans lequel a lieu la croissance des fibrilles.
Au moyen de la microscopie à force atomique à grande vitesse (HS-AFM), Watanabe-Nakayama, Ono et ses collègues ont pu enregistrer l'agrégation de fibrilles à une résolution nanométrique et à un débit vidéo élevé pour divers cas. D'abord, les scientifiques ont examiné la croissance de types de variantes uniques (auto-ensemencement). Ils ont découvert que les mutants produisaient plus d'agrégats, ou qu'ils se sont agrégés plus rapidement à pH neutre que les variants de type sauvage. Une autre observation était que l'allongement était plus rapide à un pH inférieur (5,8, c'est-à-dire acide) qu'à un pH plus élevé (7,4, c'est-à-dire basique).
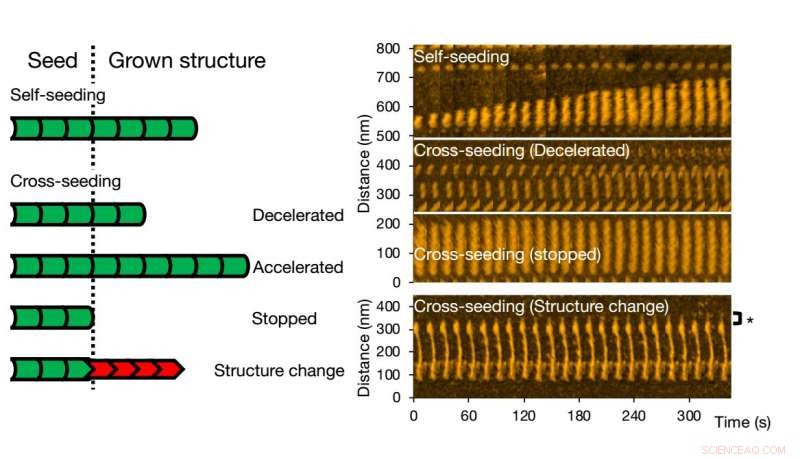
La microscopie à force atomique à grande vitesse permet de visualiser et d'analyser la formation de fibrilles de variantes d'une seule protéine. Crédit :Université de Kanazawa
Pour le semis croisé, différents scénarios peuvent se produire. La croissance des fibrilles peut être accélérée ou ralentie, ou même arrêté. La morphologie de la graine d'origine peut être préservée, mais il arrive aussi que la structure de la fibrille résultante soit différente - les formes structurelles typiques sont « droites » ou « en spirale ». Les chercheurs ont vérifié que la structure et la dynamique des fibrilles observées avec le HS-AFM correspondent aux processus en solution au moyen d'expériences de fluorescence; des conclusions similaires ont été obtenues.
Les découvertes de Watanabe-Nakayama, Ono et ses collègues sont pertinents pour mieux comprendre les maladies liées à l'amyloïde. Citant les chercheurs :« L'ensemencement croisé combiné à des variations des taux d'allongement a pour effet d'augmenter la diversité structurelle des assemblages résultants. Cette diversité peut se refléter dans des effets neurotoxiques distincts pour divers assemblages [de protéines].