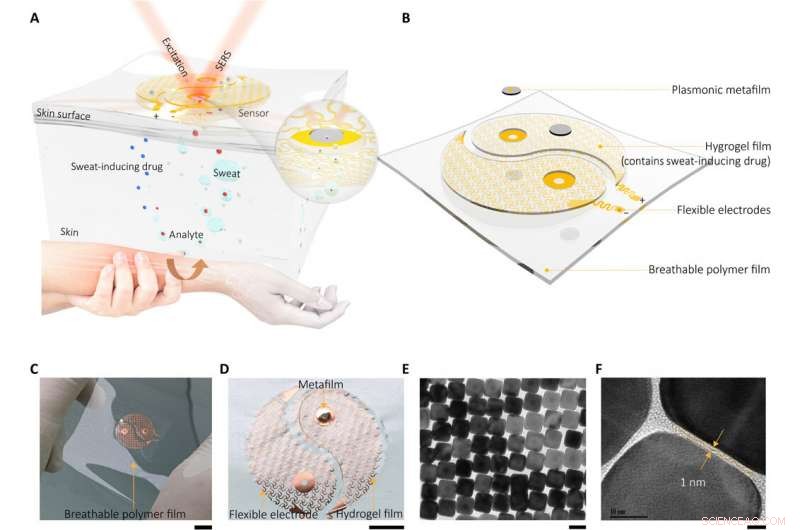
Dispositif de détection SERS portable intégré au métamatériau plasmonique. (A) Dessin schématique montrant le principe de fonctionnement et la conception de l'appareil, (B) qui se composait de deux composants principaux (composant d'extraction de sueur et composant de détection SERS) et a été conçu pour ressembler à un symbole yin-yang. La figure en médaillon met en évidence l'interface de détection clé à proximité du métafilm. (C) Image optique de l'appareil et (D) image optique agrandie du composant d'extraction de la sueur. Une fine couche d'hydrogel chargée de molécules (chlorure d'acétylcholine) qui stimulent les sécrétions des glandes sudoripares est montée sur l'électrode à mailles fractales en spirale. Notez que pour mettre en évidence le contraste pour l'exposition, une seule des électrodes a été montée avec la couche d'hydrogel et le métafilm plasmonique. Crédit photo :Yingli Wang, Université du Zhejiang. (E et F) Images de microscopie électronique à transmission (MET) à haute résolution du composant de détection SERS monté au centre de l'électrode, qui est le métafilm plasmonique formé par un super-réseau ordonné de nanocubes d'argent (NC). Barres d'échelle, 1 cm (C), 5 mm (D), 50 nm (E), et 5 nm (F). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abe4553
La technologie de détection portable est un maillon essentiel de la médecine personnalisée, où les chercheurs doivent suivre plusieurs analytes à l'intérieur du corps simultanément, pour obtenir une image complète de la santé humaine. Dans un nouveau rapport sur Avancées scientifiques , Yingli Wang et une équipe de scientifiques en biosystèmes, l'ingénierie et les sciences de l'information à l'Université de Cambridge et à l'Université du Zhejiang au Royaume-Uni et en Chine, a présenté un capteur plasmonique-électronique portable doté d'une capacité de reconnaissance moléculaire "universelle". L'équipe a introduit des métasurfaces plasmoniques flexibles avec une activité de diffusion Raman améliorée en surface (SERS) comme composant de détection fondamental. Le système contenait un processus flexible d'extraction de la sueur pour extraire de manière non invasive et empreintes digitales les analytes à l'intérieur du corps sur la base de leurs spectres de diffusion Raman uniques. Comme preuve de concept, ils ont surveillé avec succès diverses quantités de traces de médicaments à l'intérieur du corps pour obtenir un profil métabolique individuel des médicaments. Le capteur a comblé l'écart dans la technologie de détection portable pour fournir un universel, processus de suivi moléculaire sensible pour évaluer la santé humaine.
Technologie de capteur portable
Wang et al. a présenté une plate-forme de détection électronique plasmonique portable avec une capacité de reconnaissance presque "universelle". La détection portable fournit un lien vers l'avenir de la médecine personnalisée, mais de tels capteurs doivent surmonter un décalage fondamental entre une surface élastique rigide et souple pour laminer dans des biointerfaces telles que la peau, œil, nerf et dent pour évaluer en toute transparence la santé humaine. Les appareils permettent aux chercheurs d'évaluer en continu les signes vitaux, notamment la fréquence cardiaque et la température corporelle, transpiration et activités physiques. Malgré le succès des capteurs physiques portables, des techniques de suivi de molécules non invasives qui donnent un aperçu de la dynamique du corps humain au niveau moléculaire restent à réaliser. Ces capacités sont vitales pour la médecine de précision personnalisée. Dans ce cas, Wang et al. visait à développer une nouvelle stratégie avec une spécificité de cible universelle au lieu d'avoir une seule cible pour suivre simultanément plusieurs cibles. L'équipe a développé une nouvelle plate-forme utilisant une métasurface plasmonique active de spectroscopie Raman à surface améliorée flexible (SERS) pour servir de composant de détection clé et un système électronique flexible pour extraire automatiquement la sueur et les analytes du corps.
Caractérisation du composant de détection SERS de l'appareil. (A) Illustration schématique montrant le principe de détection SERS du métafilm NC. Les analytes dans la sueur extraite ont été attirés par le bas vers le point chaud EM dans le métafilm NC, qui peut être détectée in situ par la technique SERS à partir du métafilm arrière (excitation et collecte en arrière). (B) Simulation FDTD de l'amélioration du champ électrique local pour le point chaud EM dans la métasurface NC. (C) Spectres SERS du métafilm NC immergé dans la solution de molécule sonde (CV) avec diverses concentrations (une moyenne de 20 emplacements choisis au hasard pour chaque concentration avec un temps d'acquisition de 1 s et en utilisant un objectif 10 × et une puissance laser de 0,33 mW). (D) Carte d'intensité Raman (~1621 cm−1) du métafilm NC après traitement avec la sonde Raman (CV, 10-5M). (E) Comparaison des réponses SERS (~ 1621 cm-1) à diverses solutions CV en utilisant des approches de collecte en amont et en aval. (F) Spectres SERS des échantillons de sueur humaine contenant différents médicaments (0,2 M de lidocaïne, 10−3 M de cocaïne, et 10−5 M de méthotrexate) et l'échantillon de sueur à blanc (en utilisant un objectif 10× ou 50× et un laser de puissance 0,15 à 0,66 mW, avec des temps d'acquisition de 6 à 30 s). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abe4553 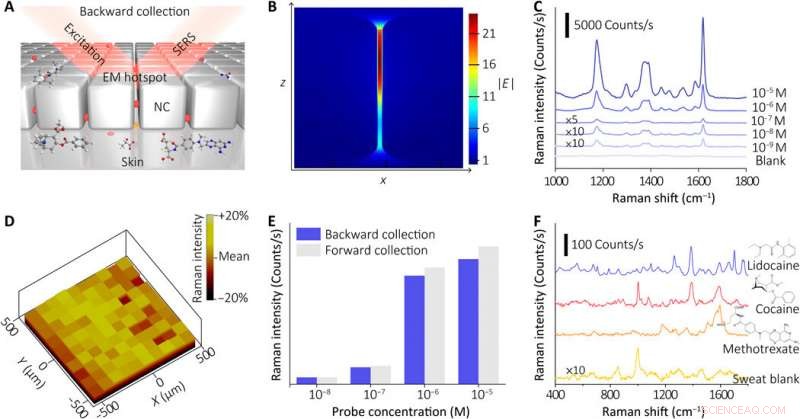
L'équipe a pris les empreintes digitales du spectre SERS unique à l'aide du capteur portable. Comme preuve de concept, ils ont détecté la variation des concentrations de médicament dans le corps humain pour obtenir le profil métabolique du médicament d'un individu. Le capteur portable intégré a comblé l'écart existant dans le diagnostic personnalisé pour le suivi en temps réel des composés biochimiques importants. Les scientifiques ont utilisé la plate-forme de détection pour surveiller les indices physiologiques ou les concentrations de médicaments dans le corps humain afin d'obtenir le profil métabolique des médicaments d'un individu. Ensuite, en utilisant le capteur portable intégré, ils ont surveillé les indices physiologiques ou les concentrations de médicament dans un système d'administration de médicament à rétroaction en boucle fermée.
Le dispositif de détection portable intégré au métamatériau plasmonique contenait deux composants principaux, dont une fine couche d'hydrogel chargée de molécules pour stimuler les sécrétions des glandes sudoripares. L'équipe a attaché ces constructions à deux électrodes à mailles fractales en spirale pour servir de composant d'extraction de la sueur. Wang et al. utilisé le procédé d'iontophorèse (administration transdermique de médicament) pour cette extraction; largement utilisé comme méthode d'échantillonnage de la sueur non invasive dans les appareils à des fins diagnostiques et thérapeutiques. Ils ont formé un méta-film plasmonique en utilisant un super-réseau de nanocubes d'argent ordonné pour servir de composant de détection monté dans la configuration expérimentale. Les forts champs électromagnétiques localisés dans le nanocube ont donné lieu à l'effet SERS (surface-enhanced Raman scattering) pour détecter les molécules approchant la surface du métafilm. Ils ont placé les deux composants sur un film polymère mince à module ultra-faible pour former un mince, support respirant et physiquement résistant pour une adhérence cutanée non irritante. A l'aide des électrodes, l'équipe a appliqué un courant électrique doux pour délivrer du chlorure d'acétylcholine dans la couche d'hydrogel aux glandes sudoripares sécrétoires pour un traitement rapide, génération de sueur localisée.
Caractéristiques mécaniques de l'appareil. (A) Images optiques du capteur sous déformation. (B) Analyse de la distribution des contraintes FEM de la zone de l'anneau de garde de l'électrode extensible sous diverses distorsions, indiquant que l'anneau de garde peut isoler de grandes déformations à l'élastomère mou, évitant ainsi des contraintes plastiques potentiellement destructrices pour le composant de détection SERS. (C) Réponses SERS du capteur sous diverses déformations. (D) Caractéristiques du capteur SERS après le test d'étirement cyclique. (E) Changements de résistance dans l'électrode sous diverses déformations. (F) Changements de résistance dans l'électrode après le test d'étirement cyclique. (G) Photographies du capteur monté sur la peau humaine et (H) dans diverses conditions. Crédit photo :Xiangjiang Liu, Université du Zhejiang. Barres d'échelle, 1 mm (B) et 1 cm (G et H). Les barres d'erreur sont définies comme ±SD. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abe4553 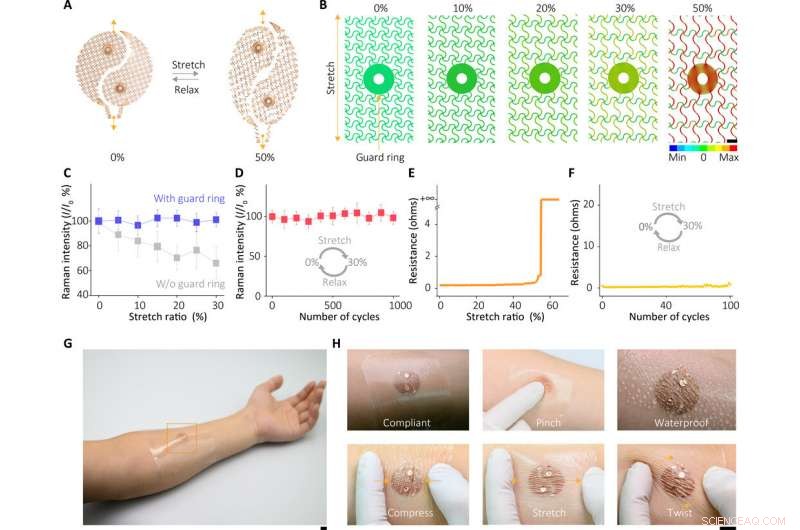
Le capteur du dispositif portable dépendait de l'effet SERS généré par le métafilm de super-réseau de nanocube d'argent ordonné, sur la base de laquelle l'équipe a détecté la cible d'intérêt dans la sueur extraite. En premier, ils ont assemblé une seule couche du réseau de nanocubes à emballage fermé à l'interface liquide/air et ont par la suite transformé la construction en un support polymère mince et flexible. Les scientifiques ont ensuite vérifié la taille moyenne de l'écart entre les nanocubes à l'aide d'images de microscopie électronique à transmission (MET) à haute résolution et ont effectué des simulations numériques dans le domaine temporel des différences finies (FDTD). La compliance mécanique et le contact cutané du métafilm ont permis des mesures de haute fidélité. L'équipe a ensuite développé le film SERS et l'a transféré sur un hydrogel chargé d'un agent agoniste fixé sur des électrodes à mailles fractales. Ils ont utilisé une conception en spirale ultrafine pour augmenter la tolérance du système induisant la sueur aux déformations mécaniques et y sont parvenus en développant une étape de conception « d'îlots interconnectés » pour former un film SERS fragile avec un système électronique souple et élastique. L'équipe a confirmé la durabilité de l'électronique après 100 cycles de test, sans aucune dégradation du signal observable pour remplir parfaitement les fonctions requises d'un capteur portable.
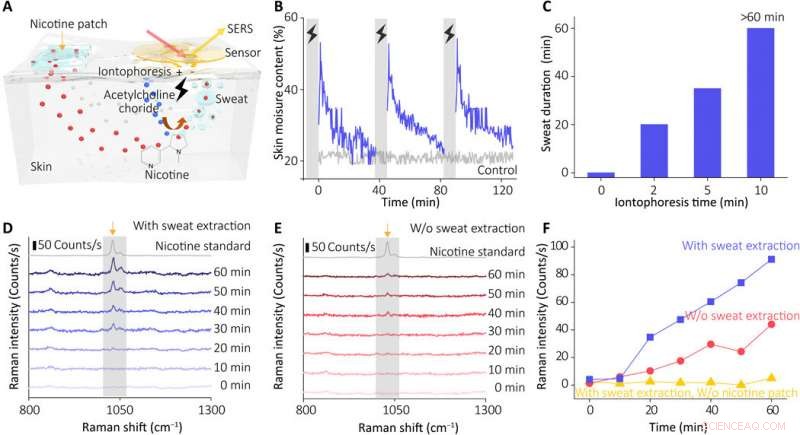
Performances de détection in vivo de notre capteur. (A) Illustration schématique montrant le principe de fonctionnement du système d'extraction de la sueur. (B) Variation de la teneur en humidité de la peau après induction de la sueur périodique (en utilisant l'hydrogel contenant 10% de chlorure d'acétylcholine, courant d'iontophorèse de 0,5 mA pendant 5 min). (C) Caractéristiques de sécrétion sudorale induite en réponse à différents temps d'iontophorèse (0 à 10 min). La durée de sécrétion représente le temps total de conductance cutanée au-dessus de la ligne de base (mesures arrêtées à 60 min). (D) Surveillance en temps réel de la nicotine dans la peau humaine à l'aide de notre capteur intégré (avec extraction de la sueur) et des groupes de contrôle (E) (sans activer le courant d'iontophorèse pour l'extraction de la sueur). Les spectres ont été collectés à l'aide d'une puissance laser de 0,33 mW et d'un objectif 10× (temps d'acquisition, 1 seconde). (F) Evolution du pic Raman caractéristique de nicotine après extraction de la sueur du groupe test et du groupe témoin (sans allumer le courant ou sans attacher le patch de nicotine). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abe4553
Application de détection biologique
Wang et al. ont ensuite recruté des volontaires sains pour des mesures in vivo (physiologiques) afin de démontrer la capacité d'extraction de la sueur de l'appareil. Les scientifiques ont utilisé la nicotine comme médicament modèle et ont surveillé la concentration réelle du médicament dans la peau par rapport à l'administration du médicament, l'absorption et le taux métabolique par individu. Au cours des expériences, ils ont utilisé un capteur SERS portable couplé à une alimentation électrique compacte et à une unité de commande sans fil sur l'avant-bras des volontaires. L'appareil a montré que le spectre SERS de nicotine dans la sueur correspondait au spectre de la norme de nicotine. Les résultats ont indiqué comment le capteur a entraîné le comportement métabolique de la nicotine pour permettre au capteur portable de surveiller la pharmacocinétique dynamique des médicaments et leur profil métabolique. Le capteur, cependant, uniquement des cibles efficacement détectées stockées dans le sous-épiderme peu profond ; donc, les chercheurs devront comprendre comment cette valeur est en corrélation avec les concentrations de médicament dans le sang ou le liquide interstitiel au cours d'études ultérieures.
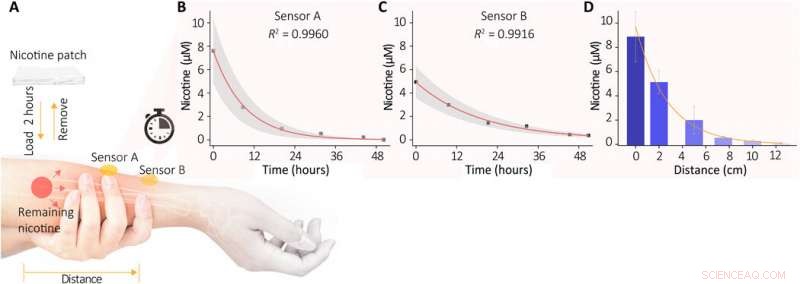
Suivi in vivo du processus de métabolisation de la nicotine dans la peau humaine. (A) Illustration schématique de l'expérience. Un patch de nicotine contenant environ 10 mg a été attaché à l'avant-bras des volontaires pendant 2 heures, puis retiré. Après avoir soigneusement nettoyé la peau, la nicotine restante dans la peau a été extraite et analysée par notre capteur. (B et C) Les évolutions des concentrations de nicotine restantes ont été mesurées à partir des deux emplacements (capteur A directement sur la zone patchée; le capteur B est fixé à environ 2 cm). Chaque mesure a été prise après 20 min d'extraction de la sueur (courant d'iontophorèse de 0,5 mA, 10 % d'hydrogel chargé de chlorure d'acétylcholine), et les réponses des capteurs des 10 minutes suivantes ont été recueillies en continu. Les taux de nicotine moyens obtenus sont indiqués sur la figure. Les zones d'ombre indiquent ±SD des mesures. (D) Dépendance à distance des concentrations de nicotine dans la sueur extraite après le patch. Six capteurs ont été positionnés le long du bras à une distance de 0 à 12,5 cm de la zone de patch. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abe4553
Perspectives
De cette façon, Yingli Wang et ses collègues ont présenté un capteur intégré plasmonique-électronique portable en tant qu'appareil portable de nouvelle génération. Par rapport aux capteurs électrochimiques portables existants, ce capteur a montré une spécificité de cible plus large et une stabilité plus élevée. Le dispositif intégré a comblé l'écart existant dans le diagnostic personnalisé et la médecine de précision pour suivre en temps réel les molécules importantes à l'intérieur du corps. L'équipe a proposé des applications pour surveiller les indices physiologiques et les concentrations de médicaments dans un système d'administration de médicaments à rétroaction en boucle fermée et s'attend à ce que le capteur portable inspire une gamme d'applications multidisciplinaires.
© 2021 Réseau Science X