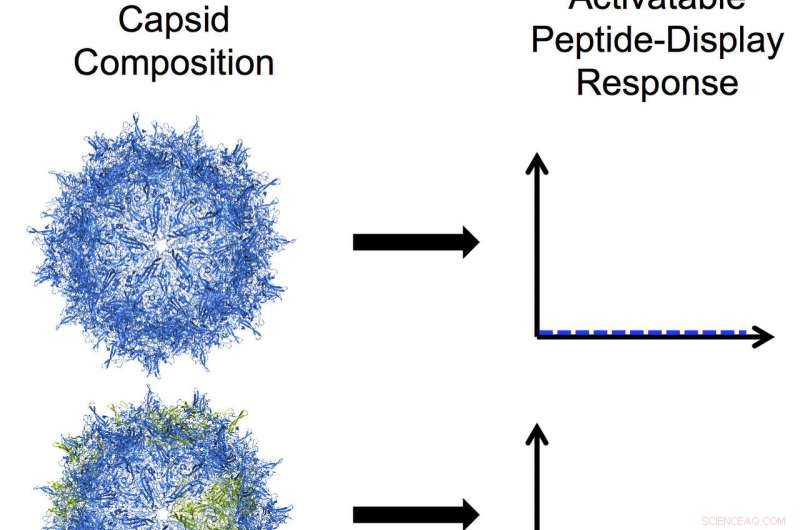
Les bio-ingénieurs de l'Université Rice ont développé des virus adéno-associés programmables en modifiant l'une des trois protéines qui s'assemblent en une coquille dure appelée capside. Dans cette illustration, les sous-unités bleues dans la capside représentent la protéine VP3 et les sous-unités vertes représentent un mutant tronqué de VP2. De haut en bas :une capside uniquement VP3 qui n'affiche aucun peptide; une capside mosaïque avec une majorité de VP3 et une petite quantité du mutant VP2 qui montre un faible niveau d'affichage peptidique activable ; une capside mosaïque avec des quantités égales de mutants VP3 et VP2 qui montre un niveau élevé d'affichage de peptides activables ; et une capside mutante VP2 homomère avec un niveau élevé de constante, affichage de peptide en forme de brosse. Crédit :Nicole Thadani/Université Rice
En rognant une protéine virale, Les scientifiques de l'Université Rice ont découvert une voie vers un virus semblable, des dispositifs à l'échelle nanométrique qui pourraient être capables d'administrer des médicaments aux cellules.
La protéine est l'une des trois qui composent l'enveloppe protectrice, appelé la capside, de virus naturels adéno-associés (AAV). En fabriquant des versions progressivement plus petites de la protéine, les chercheurs ont fabriqué des capsides aux capacités uniques et ont beaucoup appris sur les mécanismes de l'AAV.
La recherche apparaît dans la revue American Chemical Society ACS Nano .
Le bio-ingénieur du riz Junghae Suh étudie la manipulation d'AAV non pathogènes pour fournir des cargaisons utiles comme des médicaments de chimiothérapie. Ses recherches ont mené au développement de virus qui peuvent être déclenchés par la lumière ou par des protéases extracellulaires associées à certaines maladies.
Les AAV sont petits - environ 25 nanomètres - et contiennent un seul brin d'ADN à l'intérieur de capsides dures constituées d'une mosaïque de protéines appelée VP1, VP2 et VP3. Les AAV ont été utilisés pour fournir des charges utiles de thérapie génique, mais personne n'a compris comment les capsides d'AAV se reconfigurent physiquement lorsqu'elles sont déclenchées par des stimuli externes, Suh dit. C'était le point de départ de son laboratoire.
"Ce virus possède des domaines intrinsèques peptidiques (petites protéines) cachés à l'intérieur de la capside, " dit-elle. " Quand le virus infecte une cellule, il détecte le pH bas et d'autres facteurs endosomiques, et ces domaines peptidiques apparaissent à la surface de la capside du virus.
« Ce changement de conformation, que nous avons appelé un « affichage peptidique activable », ' est important pour le virus car les domaines externalisés brisent la membrane endosomale et permettent au virus de s'échapper dans le cytoplasme, " dit Suh. " En plus, les séquences de localisation nucléaire dans ces domaines permettent au virus de transiter dans le noyau. Nous pensions que nous pouvions remplacer cette fonctionnalité par quelque chose d'autre."

Nicole Thadani, la gauche, et Junghae Suh de l'Université Rice ont développé des virus adéno-associés programmables qui peuvent être utilisés pour administrer des médicaments peptidiques. Crédit :Jeff Fitlow/Université Rice
Suh et l'auteur principal et étudiante diplômée de Rice, Nicole Thadani, pensent que leurs AAV mutants peuvent devenir des « nanoparticules de bioinformatique » qui détectent et traitent les intrants environnementaux et produisent des sorties contrôlables. La modification de la capside est la première étape.
Des trois protéines naturelles de la capside, seuls VP1 et VP2 peuvent être déclenchés pour exposer leurs peptides fonctionnels, mais ni l'un ni l'autre ne peut faire une capside à lui seul. Les VP3 plus courtes peuvent former des capsides par elles-mêmes, mais n'affichent pas les peptides. Dans les AAV naturels, Les protéines VP3 sont 10 fois plus nombreuses que leurs homologues.
Cela limite le nombre de peptides qui peuvent être exposés, alors Suh, Thadani et leurs co-auteurs ont décidé de changer le ratio. Cela les a amenés à tronquer VP2 et à synthétiser des capsides mosaïques avec VP3, résultant en une modification réussie du nombre de peptides exposés. Sur la base de recherches antérieures, ils ont inséré une étiquette d'hexahistidine commune qui a facilité la surveillance de l'affichage à la surface de la région peptidique.
"Nous voulions augmenter la propriété activable de la protéine au-delà de ce qui se passe dans la capside virale native, " a déclaré Thadani. " Plutôt que d'afficher seulement cinq copies du peptide par capside, maintenant, nous pouvons peut-être en afficher 20 ou 30 et obtenir plus de la bioactivité que nous voulons."
Ils ont ensuite fabriqué une VP2 tronquée capable de former une capside à elle seule. « Les résultats étaient assez surprenants, et pas évident pour nous, " a déclaré Suh. " Nous avons suffisamment réduit ce composant VP2 pour former ce que nous appelons une capside homomère, où la capside entière est composée uniquement de cette sous-unité mutante. Cela nous a donné des virus qui semblent avoir des « brosses » peptidiques qui sont toujours à la surface.
"Une structure virale comme celle-là n'a jamais été vue dans la nature, " dit-elle. " Nous avons une particule avec cette brosse peptidique, avec des bouts libres partout. Maintenant, nous voulons savoir si nous pouvons utiliser ces bouts libres pour attacher d'autres choses ou effectuer d'autres fonctions."
Les AAV homomères affichent jusqu'à 60 peptides, tandis que les AAV en mosaïque pourraient être programmés pour répondre à des stimuli spécifiques à des cellules ou à des tissus particuliers et afficher un plus petit nombre souhaité de peptides, les chercheurs ont dit.
"Les virus ont évolué pour envahir les cellules très efficacement, " Suh a déclaré. "Nous voulons utiliser notre virus comme une plate-forme de nanoparticules pour fournir des thérapies à base de protéines ou de peptides plus efficacement dans les cellules. Nous voulons exploiter ce que la nature a déjà créé, modifiez-le un peu et utilisez-le à nos fins."