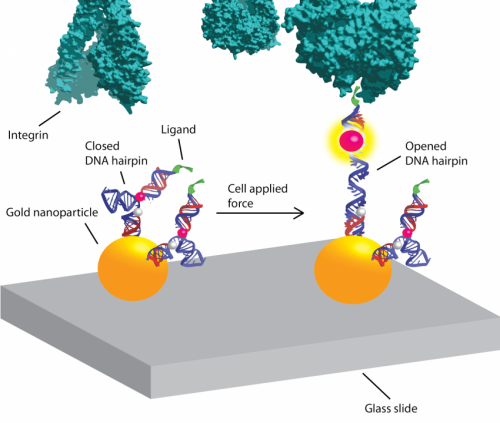
"Notre postulat est que la mécanique joue un rôle dans presque tous les processus biologiques, et avec ces sondes de tension basées sur l'ADN, nous allons découvrir, mesurer et cartographier ces forces, », explique le chimiste biomoléculaire Khalid Salaita. Crédit :Victor Ma.
Cellules adhérentes, le genre qui forme l'architecture de tous les organismes multicellulaires, sont conçus mécaniquement avec des forces précises qui leur permettent de se déplacer et de coller aux choses. Des protéines appelées récepteurs d'intégrine agissent comme de petites mains et de petits pieds pour tirer ces cellules sur une surface ou pour les ancrer en place. Lorsque des groupes de ces cellules sont placés dans une boîte de Pétri avec une variété de substrats, ils peuvent détecter les différences entre les surfaces et ils « ramperont » vers le plus rigide qu'ils puissent trouver.
Maintenant, les chimistes ont mis au point une méthode utilisant des sondes de tension basées sur l'ADN pour zoomer au niveau moléculaire et mesurer et cartographier ces phénomènes :comment les cellules détectent mécaniquement leur environnement, migrer et adhérer aux choses.
Communication Nature publié la recherche, dirigé par le laboratoire de Khalid Salaita, professeur assistant de chimie biomoléculaire à l'Université Emory. Les co-auteurs comprennent des ingénieurs en mécanique et en biologie de Georgia Tech.
Grâce à leur nouvelle méthode, les chercheurs ont montré comment les forces appliquées par les cellules fibroblastiques sont réellement distribuées au niveau de la molécule individuelle. "Nous avons découvert que chacun des récepteurs d'intégrine sur le périmètre des cellules "ressentit" fondamentalement la mécanique de son environnement, " dit Salaita. " Si la surface qu'ils sentent est plus douce, ils s'en détacheront et si c'est plus rigide, ils se lieront. Ils aiment planter leurs piquets dans un sol ferme."
Chaque cellule possède des milliers de ces récepteurs d'intégrine qui s'étendent sur la membrane cellulaire. Les biologistes cellulaires se sont depuis longtemps concentrés sur les aspects chimiques de la façon dont les récepteurs des intégrines détectent l'environnement et interagissent avec lui, tandis que la compréhension des aspects mécaniques a pris du retard. La mécanique cellulaire est un domaine relativement nouveau mais en pleine croissance, qui implique également des biophysiciens, ingénieurs, chimistes et autres spécialistes.
"Beaucoup de bonnes et de mauvaises choses qui se produisent dans le corps sont médiées par ces récepteurs d'intégrines, tout, de la cicatrisation des plaies au cancer métastatique, il est donc important d'avoir une image plus complète du fonctionnement de ces mécanismes, " dit Salaita.
Le laboratoire Salaita a précédemment développé une technique de capteur fluorescent pour visualiser et mesurer les forces mécaniques à la surface d'une cellule à l'aide de polymères flexibles qui agissent comme de minuscules ressorts. Ces ressorts sont modifiés chimiquement aux deux extrémités. Une extrémité reçoit un capteur d'activation basé sur la fluorescence qui se liera à un récepteur d'intégrine à la surface de la cellule. L'autre extrémité est ancrée chimiquement à une lame de microscope et à une molécule qui éteint la fluorescence. Lorsqu'une force est appliquée au ressort en polymère, il s'étend. La distance de l'extincteur augmente et le signal fluorescent s'allume et devient plus lumineux. La mesure de la quantité de lumière fluorescente émise détermine la quantité de force exercée.
Yun Zhang, un co-auteur de la Communication Nature papier et un étudiant diplômé du laboratoire Salaita, eu l'idée d'utiliser des balises moléculaires à ADN au lieu de polymères flexibles. "Elle était nouvelle dans le laboratoire et a apporté une nouvelle perspective, " dit Salaita.
Les récepteurs des intégrines sur les cellules fibroblastiques, dessus, "sont des sortes de bêtes, " dit Salaita. " Ils appliquent des forces relativement élevées afin d'adhérer à la matrice extracellulaire. " Crédit :photo NIH.
Les balises moléculaires sont de courts morceaux d'ADN synthétisé en laboratoire, chacun constitué d'environ 20 paires de bases, utilisé dans le diagnostic clinique et la recherche. Les balises sont appelées épingles à cheveux ADN en raison de leur forme.
La thermodynamique de l'ADN, sa structure en hélice double brin et l'énergie nécessaire à son repliement sont bien comprises, faire des épingles à cheveux de l'ADN des instruments plus raffinés pour mesurer la force. Un autre avantage clé est le fait que leurs extrémités sont toujours à la même distance, Salaita dit, contrairement aux bobines aléatoires de polymères flexibles.
Dans les expériences, les épingles à cheveux ADN se sont avérées fonctionner plus comme un interrupteur à bascule qu'un gradateur. "Les sondes de tension à base de polymère se déroulent progressivement et deviennent plus lumineuses à mesure que plus de force est appliquée, " dit Salaita. " En revanche, Les épingles à cheveux ADN ne bougent pas tant que vous n'appliquez pas une certaine force. Et une fois cette force appliquée, ils commencent à se décompresser et continuent de s'effilocher."
En outre, les chercheurs ont pu calibrer la constante de force des épingles à cheveux d'ADN, les rendant hautement ajustables, instruments numériques pour calculer la quantité de force appliquée par une molécule, jusqu'au niveau piconewton.
"La force de gravité sur une pomme est d'environ un newton, donc nous parlons d'un million-millionième de cela, " Dit Salaita. " C'est assez ahurissant de voir que c'est le peu de force dont vous avez besoin pour déplier un morceau d'ADN. "
Le résultat est une sonde de tension qui est trois fois plus sensible que les sondes polymères.
Dans un document séparé, Publié dans Lettres nano , le laboratoire Salaita a utilisé les sondes à base d'ADN pour expérimenter comment la densité d'un substrat affecte la force appliquée. "Intuitivement, vous pourriez penser qu'un environnement moins dense, offrant moins de points d'ancrage, entraînerait plus de force par ancre, " a déclaré Salaita. "Nous avons constaté que c'est en fait le contraire:vous allez voir moins de force par ancre."
Le mécanisme de détection de l'espacement des ligands et de leur adhésion à un substrat semble être médié par la force, il dit. "Les récepteurs d'intégrine doivent être étroitement espacés pour que le moteur de la cellule qui génère la force s'engage avec eux et engage la force."
Maintenant, les chercheurs utilisent les outils basés sur l'ADN qu'ils ont développés pour étudier les forces de voies et de récepteurs cellulaires plus sensibles.
"Les récepteurs intégraux sont des sortes de bêtes, ils appliquent des forces relativement élevées pour adhérer à la matrice extracellulaire, ", dit Salaita. "Il existe de nombreux récepteurs cellulaires différents qui appliquent des forces beaucoup plus faibles."
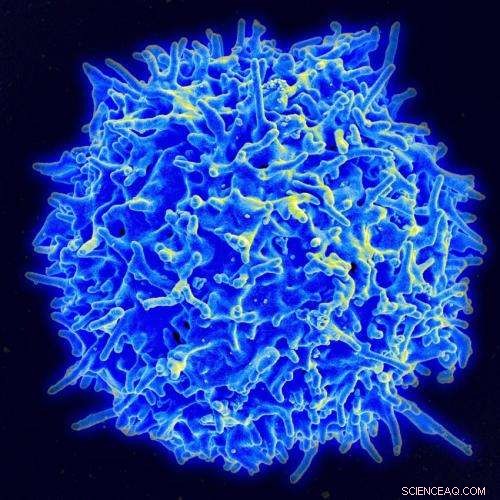
Les lymphocytes T sont des globules blancs dont les récepteurs ne sont pas focalisés sur l'adhésion, mais sur des activités comme l'identification de divers peptides. Micrographie électronique d'une cellule T humaine par le NIAID/NIH.
cellules T, par exemple, sont des globules blancs dont les récepteurs ne se concentrent pas sur l'adhésion mais sur des activités telles que la distinction d'un auto-peptide amical d'un peptide bactérien étranger.
Le laboratoire Salaita collabore avec des chercheurs médicaux à travers Emory pour comprendre le rôle de la mécanique cellulaire dans le système immunitaire, la coagulation du sang et la structuration neuronale des axones.
"Essentiellement, notre prémisse est que la mécanique joue un rôle dans presque tous les processus biologiques, et avec ces sondes de tension basées sur l'ADN, nous allons découvrir, mesurer et cartographier ces forces, " dit Salaita.