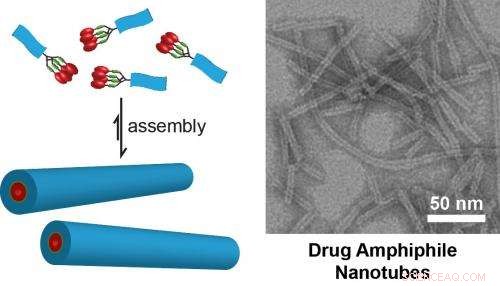
(À gauche) Illustration schématique du concept de conception d'amphiphiles médicamenteux à auto-assemblage. La charge de médicament dans les nanostructures auto-assemblées est définie par la nature de la conception moléculaire. (À droite) Image MET de nanotubes formés par auto-assemblage d'un médicament amphiphile contenant quatre médicaments à base de camptothécine. Ces nanotubes possèdent une charge de médicament fixe de 38 % (p/p). Image du Cui Lab de l'Université Johns Hopkins. Crédit :Cui Lab, Département de génie chimique et biomoléculaire, Université Johns Hopkins
(Phys.org) — Ces dernières années, de nombreux traitements contre le cancer populaires utilisent nano, C'est, de minuscules particules de polymères ou de matériaux à base de carbone pour transporter les médicaments de chimiothérapie vers les tumeurs d'une manière qui cible spécifiquement les cellules cancéreuses, tout en épargnant les cellules normales. Mais cette approche présente plusieurs problèmes.
Entre autres, il est difficile de contrôler la quantité de médicament chargée dans le support, et, En réalité, trop souvent, il y a beaucoup plus de matière « porteuse » que de drogue. Par conséquent, la quantité de médicament varie souvent d'une particule à l'autre, ce qui signifie que la dose de chimiothérapie délivrée peut être incohérente ou inégale. Aussi, le matériau synthétique qui enferme et délivre le médicament peut lui-même être toxique, provoquant des effets secondaires indésirables.
Le scénario idéal serait de trouver un moyen de transformer les médicaments anticancéreux en leurs propres systèmes d'administration, et éliminer complètement les véhicules synthétiques.
Honggang Cui, professeur adjoint de génie chimique et biomoléculaire à l'Université Johns Hopkins essaie de faire exactement cela en transformant les molécules médicamenteuses d'une manière qui leur permet de devenir leurs propres porteurs, un processus connu sous le nom d'auto-assemblage.
"Nous voulons utiliser le médicament anticancéreux pour fabriquer des nanoparticules à partir de lui-même, " dit Cui, également membre du corps professoral affilié du Johns Hopkins Institute for NanoBioTechnology. « Le défi est : comment faisons-nous cela ? »
Le scientifique financé par la National Science Foundation (NSF) et son équipe de recherche utilisent de nouvelles techniques d'ingénierie moléculaire qui, espèrent-ils, inciteront les molécules médicamenteuses à s'organiser en nanostructures discrètes et isolées, plutôt que de rester sous leur forme actuelle « en vrac ».
S'il réussit, les travaux pourraient potentiellement améliorer la chimiothérapie anticancéreuse en augmentant l'efficacité du traitement, et réduire ses effets secondaires indésirables.
Actuellement, "dans une particule, vous pouvez avoir 2 % de charge de médicament, et dans un autre, peut-être 10 pour cent, et dans un autre, rien, pas de drogue du tout, ", dit-il. Faire transporter les médicaments eux-mêmes " aidera le résultat clinique, " Cui ajoute. " Vous n'obtiendrez pas trop ou pas assez de drogue. Vous obtiendrez la bonne dose."
Afin de transformer ces médicaments en leurs propres systèmes d'administration à l'échelle nanométrique, ils doivent devenir amphiphiles, ce qui signifie qu'ils doivent avoir des propriétés qui aiment et n'aiment pas l'eau.
"Le segment de l'aversion pour l'eau conduira les molécules à se rassembler pour former un cluster moléculaire, ou une nanostructure, de manière à minimiser leur contact avec les molécules d'eau, tandis que le segment aqueux maintiendra la nanostructure soluble dans une solution aqueuse et l'empêchera de se développer en objets plus gros, " explique Cui.
Peu de médicaments ont cette dualité en ce qui concerne l'eau. « La plupart sont très hydrophobes ; ils ont une faible solubilité dans l'eau, " il dit.
Pour rendre les drogues qui détestent l'eau capables d'aimer aussi l'eau, les chercheurs expérimentent des peptides hydrosolubles, qui sont des composés constitués de deux ou plusieurs acides aminés, essayer de les incorporer dans les médicaments via des linkers biodégradables, C'est, liaisons chimiques qui agissent comme un pont entre le peptide qui aime l'eau et le médicament qui déteste l'eau.
Quand ça marche, "le médicament peut devenir auto-assemblant, " dit-il. " Lorsque le médicament acquiert la capacité de s'auto-assembler, nous voulons jouer avec la séquence peptidique pour maîtriser sa taille, chimie de la forme et de la surface.
"Le peptide ajoutera non seulement le segment amoureux de l'eau pour l'auto-assemblage, mais aussi de nouvelles fonctionnalités qui permettent une régulation efficace de leur assemblage en différentes tailles et formes, " ajoute-t-il. "Ils pourraient être bioactifs, et présentent des signaux pour un ciblage tumoral spécifique."
L'espoir est de produire des médicaments anticancéreux qui sont des nanostructures supramoléculaires, ou des particules constituées de plus d'une molécule, qui "ont une charge médicamenteuse élevée et une charge médicamenteuse fixe, " dit Cui.
"Le chargement au sein de la nanostructure est défini par la conception moléculaire, " il ajoute " Si la fraction médicamenteuse dans la molécule conçue est de 10 pour cent, la nanostructure aura également une charge de médicament de 10 pour cent. Par conséquent, grâce à la conception moléculaire, on peut régler avec précision le chargement du médicament dans la nanostructure. »
Cui mène ses recherches dans le cadre d'un prix NSF Faculty Early Career Development (CAREER) commençant cette année. Le prix soutient les jeunes professeurs qui incarnent le rôle des enseignants-chercheurs grâce à des recherches exceptionnelles, une excellente éducation et l'intégration de l'éducation et de la recherche dans le contexte de la mission de leur organisation. NSF finance son travail avec environ 500 $, 000 sur cinq ans.
Cui et son équipe ont récemment publié les résultats de leurs travaux dans le Journal de l'American Chemical Society démontrant le principe de la construction de médicaments anticancéreux supramoléculaires auto-délivrants. Leurs travaux ont produit des nanofibres et des nanotubes formés par auto-assemblage de conjugués peptide-anticancéreux.
Dans le cadre de l'action éducative de la subvention, Cui prévoit d'inviter des lycéens et des collégiens locaux à passer du temps dans son laboratoire.
« La délivrance de médicaments est intrinsèquement un domaine multidisciplinaire qui offre d'énormes possibilités d'éducation à tous les niveaux, " dit-il. " Nous voulons particulièrement inciter les élèves des écoles publiques du centre-ville à se renseigner sur les systèmes d'administration de médicaments, et les meilleurs moyens d'améliorer le traitement du cancer."
Bien que ses idées soient encore loin d'une utilisation clinique, Cui pense qu'en fin de compte, il sera possible de transformer les médicaments en blocs de construction moléculaires qui agiront comme leurs propres systèmes d'administration.
"Je ne vois aucune raison pour laquelle ces médicaments à libération automatique ne pourraient pas être traduits en milieu clinique une fois que nous aurons trouvé des moyens de manipuler leur comportement d'auto-assemblage, " il dit.