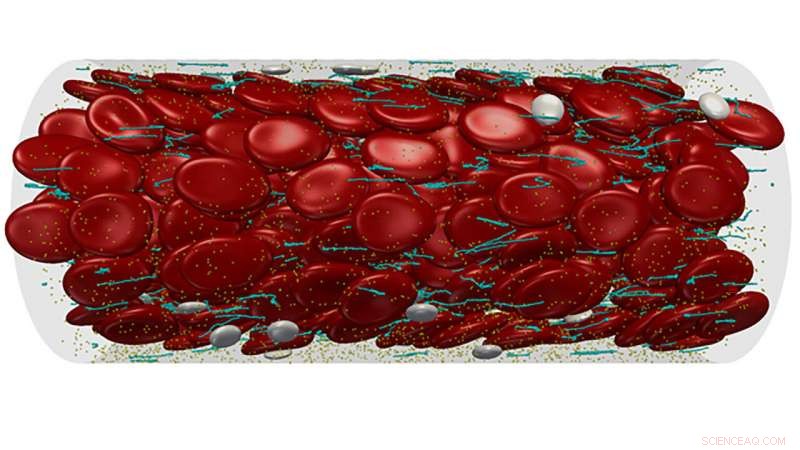
Les chercheurs passent en revue les travaux récents sur la compréhension du comportement du facteur con Willebrand dans la bioingénierie APL, peindre un portrait de vWF, et en mettant en avant les avancées dans le domaine, les auteurs ont proposé des voies prometteuses pour des thérapies dans le contrôle de ces protéines.Modélisation à plusieurs échelles d'un flux sanguin complexe à travers un microvaisseau. Crédits :Zixiang Liu
Les caillots sanguins sont depuis longtemps impliqués dans les crises cardiaques et les accidents vasculaires cérébraux, représentant ensemble près de la moitié des décès chaque année aux États-Unis. Alors que le rôle d'une protéine clé dans le processus, appelé facteur de von Willebrand, a été établi, un modèle fiable pour prédire comment le vWF s'accumule dans les vaisseaux sanguins reste insaisissable.
Des chercheurs du Georgia Institute of Technology ont publié une revue des travaux récents sur la compréhension du comportement du vWF dans APL Bio-ingénierie . L'article dresse un portrait du vWF, qui se déroule sous la contrainte de cisaillement du flux sanguin pour former des filets qui piègent les plaquettes qui passent, qui forment alors un caillot de sang, appelé thrombus. En mettant en avant les avancées dans le domaine, les auteurs ont proposé des pistes thérapeutiques prometteuses pour contrôler ces protéines.
"Le thrombus doit bloquer le flux sanguin lorsqu'il se ferme, comme essayer d'utiliser votre pouce au bout d'un tuyau d'arrosage puis arrêter tout écoulement avec de la boue, " a déclaré David Ku, un auteur sur le papier. "C'est extrêmement difficile à accomplir, donc la thrombose nécessite le plus rapide, les liens les plus forts de toute la biologie."
L'un des défis est que de nombreux modèles expérimentaux d'aujourd'hui ne peuvent imager que des événements à l'échelle du micron toutes les secondes environ. protéines vWF, cependant, sont environ un millième de cette taille, et leurs interactions se produisent dans un millième de ce temps.
Une variété de modèles informatiques ont été proposés pour combler le fossé de la micro-échelle à la nano-échelle dans la formation de caillots, allant des simulations basées sur le temps qu'il faut pour que les caillots se forment à des modèles informatiques intensifs qui recréent la façon dont les plaquettes, Le vWF et les cellules interagissent tous dans la circulation sanguine. L'article appelle les chercheurs de toute la biologie, l'informatique et d'autres domaines à collaborer pour construire un modèle amélioré.
En plus de cibler l'agrégation plaquettaire et les environnements à fort cisaillement qui étirent le vWF, une thérapie potentielle consiste à augmenter l'activité d'une autre protéine, ADAMTS13, qui clive le vWF et le rend incapable de former des caillots. Alors que la recherche sur des modèles de souris est prometteuse, beaucoup de travail est encore nécessaire pour déterminer si les thérapies ADAMTS13 seraient sûres ou efficaces pour les humains.
Les propres recherches de Ku ont mis en évidence des nanoparticules chargées négativement qui, selon la modélisation informatique, pourraient maintenir le vWF dans son état non réactif enroulé. Le groupe a découvert que les nanoparticules réduisent la rapidité avec laquelle les vaisseaux s'obstruent et explorent comment expliquer et optimiser ce processus.
Ku a déclaré qu'il espérait que le document inspirerait d'autres personnes à approfondir de nouvelles façons de mesurer et de comprendre le vWF formant des caillots.