Figure 1 :Deux faisceaux laser interagissent avec des molécules à la surface de la glace, former un nouveau faisceau avec une couleur différente. La couleur et l'intensité de ce faisceau laser contiennent des informations détaillées sur la structure moléculaire de la surface de la glace. Crédit :Organisation néerlandaise pour la recherche scientifique (NWO)
C'est à une température de -70 °C que les molécules d'eau à la surface de la glace établissent le plus de liaisons entre elles. Chercheurs de l'AMOLF, avec une équipe internationale de collègues, décrivez cela dans un article de Lettres d'examen physique publié le 28 septembre. Il est important de comprendre le comportement de la couche supérieure de glace pour comprendre comment les glaciers se déplacent, comment surgissent les avalanches, et pourquoi on peut patiner sur glace, entre autres.
L'eau est une substance étrange :elle se dilate lorsqu'elle gèle. Comme la forme solide de l'eau (glace) a une densité plus faible que la variante liquide, la glace flotte sur l'eau. Cela signifie que vous pouvez patiner sur un lac pendant un hiver rigoureux pendant que les poissons en dessous continuent de nager. Cette propriété inhabituelle est causée par la structure moléculaire de l'eau. Une molécule d'eau est constituée d'un atome d'oxygène et de deux atomes d'hydrogène. Les atomes d'hydrogène forment heureusement une liaison forte avec un atome d'oxygène d'une autre molécule d'eau :nous appelons cela une liaison hydrogène.
Chaque atome d'oxygène peut se lier à au plus quatre atomes d'hydrogène :deux de sa propre molécule d'eau, et deux de molécules voisines. Cela peut arriver au centre d'un bloc de glace profondément gelée, dans lequel les molécules d'eau prennent une structure cristalline qui ressemble à une collection d'hexagones réguliers. Cette structure cristalline prend beaucoup de place, et c'est ce qui rend la densité de la glace faible.
Cependant, les molécules d'eau à la surface de la glace ont un problème. Ces molécules d'eau ne se trouvent pas à l'interface avec d'autres molécules d'eau mais avec l'air, ils ne peuvent donc pas utiliser au maximum leurs possibilités de liaison.
Nombre maximal d'obligations
Le chercheur AMOLF Wilbert Smit et le chef du groupe AMOLF Huib Bakker ont étudié comment la structure de la couche de glace la plus externe change en raison de la température. Ils ont découvert qu'à une température ambiante d'environ -70°C, les molécules d'eau à la surface de la glace forment un maximum de liaisons hydrogène. Les chercheurs ont également trouvé une explication à cela.
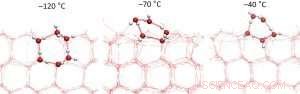
Figure 2 :Coupes transversales de la surface de la glace à différentes températures. La structure hexagonale commence à fondre à des températures inférieures à -70 °C, ce qui conduit initialement à une densité plus élevée de liaisons hydrogène à la surface de la glace. À -70 °C, le nombre maximal de liaisons hydrogène est atteint. Crédit :Organisation néerlandaise pour la recherche scientifique (NWO)
"S'il fait beaucoup plus froid que -70°C, alors la couche la plus externe de la glace a la même structure que les hexagones réguliers en dessous, mais soigneusement coupé en deux. Vous pouvez comparer la structure à une maison semi-construite où les tiges du béton armé dépassent encore des murs du premier étage", dit Wilbert Smit.
Au fur et à mesure que la température augmente, la surface de la glace devient moins structurée car les molécules d'eau acquièrent plus d'énergie cinétique. À la suite de cela, ils se réarrangent de telle sorte que le nombre de liaisons entre les molécules d'eau augmente initialement. Ce réarrangement donne une densité plus élevée de liaisons hydrogène à une température de -70°C.
A des températures supérieures à -70°C, le nombre de liaisons entre les molécules diminue à nouveau :la couche supérieure se comporte de plus en plus comme de l'eau et moins comme de la glace. Ça signifie, par exemple, que la surface de la glace sur laquelle nous patinons n'est pas réellement de la glace mais une couche d'eau.
Simulations et technique sensible
Les chercheurs néerlandais ont utilisé une technique avancée pour la recherche appelée spectroscopie de génération de fréquence somme. Cette technique permet de détecter les vibrations des molécules sur les surfaces en éclairant la surface avec deux faisceaux lumineux laser femtosecondes intenses. Dans les bonnes conditions, les faisceaux lumineux interagissent avec les molécules à la surface et un faisceau lumineux de couleur différente est formé. Cela n'a lieu que lorsque les faisceaux sont réfléchis sur la surface et non sur la structure sous-jacente. La couleur et l'intensité du nouveau faisceau contiennent donc exclusivement des informations détaillées sur la structure de la surface. A l'aide des simulations de l'Institut Max Planck de Mayence, les chercheurs ont pu traduire ces résultats en nouvelles connaissances sur la surface de la glace.