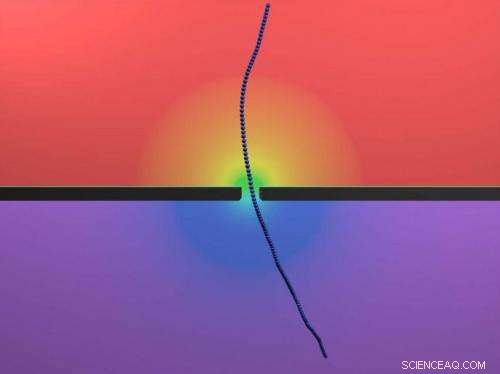
Une simulation informatique représente un virus fd se déplaçant à travers un nanopore. Contrairement à l'ADN, qui s'emmêle en solution, le fd reste raide et droit, permettant aux chercheurs d'étudier la physique de la translocation à travers les nanopores. Crédit : Hendrick de Haan/Stein lab/Brown University
Les nanopores pourraient un jour révolutionner le séquençage de l'ADN. En faisant glisser les molécules d'ADN une à une à travers de minuscules trous dans une fine membrane, il peut être possible de décoder de longues étendues d'ADN à la vitesse de l'éclair. Scientifiques, cependant, n'ont pas tout à fait compris la physique de la façon dont les brins de polymère comme l'ADN interagissent avec les nanopores. Maintenant, à l'aide d'un type particulier de virus, des chercheurs de l'Université Brown ont jeté un nouvel éclairage sur cette physique à l'échelle nanométrique.
"Ce qui nous a intéressé, c'est que tout le monde sur le terrain a étudié l'ADN et développé des modèles sur la façon dont ils interagissent avec les nanopores, " a déclaré Derek Stein, professeur agrégé de physique et d'ingénierie à Brown qui a dirigé la recherche. "Mais même les choses les plus élémentaires que vous espérez que les modèles prédisent à partir des propriétés de base de l'ADN, vous ne pouviez pas le faire. La seule façon de sortir de cette ornière était d'étudier quelque chose de différent."
Les résultats, publié aujourd'hui dans Communication Nature , pourrait non seulement aider au développement de dispositifs à nanopores pour le séquençage de l'ADN, ils pourraient également conduire à une nouvelle façon de détecter les agents pathogènes dangereux.
Redresser la physique
Le concept derrière le séquençage des nanopores est assez simple. Un trou de quelques milliardièmes de mètre de large est percé dans une membrane séparant deux bassins d'eau salée. Un courant électrique est appliqué au système, qui attrape parfois un brin d'ADN chargé et le fait passer à travers le pore, un phénomène appelé translocation. Lorsqu'une molécule se déplace, il provoque des variations détectables du courant électrique à travers le pore. En examinant attentivement ces variations de courant, les scientifiques peuvent être capables de distinguer des nucléotides individuels - les A, C's, Les G et les T codés dans les molécules d'ADN.
Les premiers séquenceurs nanopores disponibles dans le commerce pourraient n'être disponibles que dans quelques années, mais malgré les avancées dans le domaine, étonnamment, on sait peu de choses sur la physique de base impliquée lorsque les polymères interagissent avec les nanopores. C'est en partie à cause de la complexité de l'étude de l'ADN. En solution, Les molécules d'ADN forment des boules de gribouillis aléatoires, ce qui rend la compréhension de leur comportement physique extrêmement difficile.
Par exemple, les facteurs régissant la vitesse de translocation de l'ADN ne sont pas bien compris. Parfois, les molécules passent rapidement à travers un pore; d'autres fois, ils glissent plus lentement, et personne ne comprend complètement pourquoi.
Une explication possible est que la configuration ondulée de l'ADN fait que chaque molécule subit des différences de traînée lorsqu'elle est tirée à travers l'eau vers le pore. "Si une molécule est froissée à côté du pore, il a une distance plus courte à parcourir et subit moins de traînée, " a déclaré Angus McMullen, un étudiant diplômé en physique à Brown et l'auteur principal de l'étude. "Mais s'il est étiré, il se sentira traîné sur toute la longueur et cela le ralentira."
L'effet de traînée est impossible à isoler expérimentalement en utilisant l'ADN, mais le virus que McMullen et ses collègues ont étudié offrait une solution.

Le virus fd, raide et en forme de tige, aide les scientifiques à comprendre la physique des nanopores. Les nanopores pourraient être utiles pour détecter d'autres virus partageant ces caractéristiques, notamment Ebola et Marburg.
Les chercheurs ont examiné fd, un virus inoffensif qui infecte e. bactéries coli. Deux choses font du virus un candidat idéal pour une étude avec des nanopores. D'abord, Les virus fd sont tous des clones identiques les uns des autres. Seconde, contrairement à l'ADN ondulé, le virus fd est un raide, molécule en forme de bâtonnet. Parce que le virus ne se recroqueville pas comme le fait l'ADN, l'effet de la traînée sur chacun devrait être essentiellement le même à chaque fois.
La traînée étant éliminée comme source de variation de la vitesse de translocation, les chercheurs s'attendaient à ce que la seule source de variation soit l'effet du mouvement thermique. Les minuscules molécules virales se heurtent constamment aux molécules d'eau dans lesquelles elles sont immergées. Quelques coups de pied thermiques aléatoires de l'arrière accéléreraient le virus lorsqu'il traverserait le pore. Quelques coups de pied de devant le ralentiraient.
Les expériences ont montré que si le mouvement thermique expliquait une grande partie de la variation de la vitesse de translocation, ça n'expliquait pas tout. A la grande surprise des chercheurs, ils ont trouvé une autre source de variation qui augmentait lorsque la tension à travers le pore augmentait.
"Nous pensions que la physique serait limpide, " dit Jay Tang, professeur agrégé de physique et d'ingénierie à Brown et l'un des co-auteurs de l'étude. « Vous avez ce [virus] rigide avec un diamètre et une taille bien définis et vous vous attendez à un signal très clair. nous avons trouvé une physique déroutante que nous ne pouvons que partiellement nous expliquer."
Les chercheurs ne peuvent pas dire avec certitude ce qui cause la variation qu'ils ont observée, mais ils ont quelques idées.
"Il a été prédit que selon l'endroit où [un objet] se trouve à l'intérieur du pore, il peut être tiré plus fort ou plus faiblement, " dit McMullen. " Si c'est au centre du pore, il tire un peu plus faible que s'il est juste sur le bord. C'est prédit, mais jamais vérifié expérimentalement. Cela pourrait être une preuve de ce qui se passe, mais nous faisons toujours un travail de suivi."
Vers un séquenceur nanopore et plus
Une meilleure compréhension de la vitesse de translocation pourrait améliorer la précision du séquençage des nanopores, dit McMullen. Il serait également utile dans la tâche cruciale de mesurer la longueur des brins d'ADN. "Si vous pouvez prédire la vitesse de translocation, " McMullen a dit, « alors vous pouvez facilement obtenir la longueur de l'ADN à partir de la durée de sa translocation. »
La recherche a également permis de révéler d'autres aspects du processus de translocation qui pourraient être utiles dans la conception de futurs dispositifs. L'étude a montré que le courant électrique a tendance à aligner les virus tête la première sur le pore, mais dans les occasions où ils ne sont pas alignés, ils ont tendance à rebondir sur le bord du pore jusqu'à ce qu'un mouvement thermique les aligne pour le traverser. Cependant, lorsque la tension est devenue trop élevée, les effets thermiques ont été supprimés et le virus s'est collé à la membrane. Cela suggère un point idéal de tension où la translocation tête la première est la plus probable.
Rien de tout cela n'est observable directement - le système est tout simplement trop petit pour être vu en action. Mais les chercheurs ont pu déduire ce qui se passait en examinant de légers changements dans le courant à travers le pore.
"Quand les virus manquent, ils secouent et on voit ces petites bosses dans le courant, " dit Stein. " Alors avec ces petites bosses, nous commençons à avoir une idée de ce que fait la molécule avant qu'elle ne glisse. Normalement, ces capteurs sont aveugles à tout ce qui se passe jusqu'à ce que la molécule glisse à travers."
Cela aurait été impossible à observer en utilisant l'ADN. La souplesse de la molécule d'ADN lui permet de traverser un pore dans une configuration repliée même si elle n'est pas alignée de front. Mais parce que le virus est raide, il ne peut pas se plier pour passer. Cela a permis aux chercheurs d'isoler et d'observer ces dynamiques de contact.
"Ces virus sont uniques, " Stein a dit. " Ils sont comme de parfaits petits étalons. "
En plus d'éclairer la physique fondamentale, le travail pourrait également avoir une autre application. Alors que le virus fd lui-même est inoffensif, les bactéries qu'il infecte—e. coli - ne l'est pas. Sur la base de ce travail, il pourrait être possible de construire un dispositif nanopore pour détecter la présence de fd, et par procuration, e. coli. D'autres virus dangereux, dont Ebola et Marburg, partagent la même structure en forme de bâtonnet que fd.
"Cela pourrait être un moyen facile de détecter ces virus, " Tang a dit. " C'est donc une autre application potentielle pour cela. "