Les atomes sont les « éléments constitutifs de la matière ». Tout ce qui a de la masse et occupe de l'espace (en ayant du volume) est composé de ces minuscules petites unités. Cela vaut pour l'air que vous respirez, l'eau que vous buvez et votre corps lui-même.
Les isotopes sont un concept essentiel dans l'étude des atomes. Chimistes, les physiciens et les géologues les utilisent pour donner un sens à notre monde. Mais avant de pouvoir expliquer ce que sont les isotopes – ou pourquoi ils sont si importants – nous devrons prendre du recul et examiner les atomes dans leur ensemble.
Comme vous le savez probablement, les atomes ont trois composants principaux, dont deux résident dans le noyau. Situé au centre de l'atome, le noyau est un amas de particules très compact. Certaines de ces particules sont des protons, qui ont des charges électriques positives.
Il est bien documenté que les charges opposées s'attirent. Pendant ce temps, des corps de même charge ont tendance à se repousser. Voici donc une question :comment deux ou plusieurs protons — avec leurs charges positives — peuvent-ils coexister dans le même noyau ? Ne devraient-ils pas se repousser ?
C'est là qu'interviennent les neutrons. Les neutrons sont des particules subatomiques qui partagent des noyaux avec des protons. Mais les neutrons ne possèdent pas de charge électrique. Fidèle à leur nom, les neutrons sont neutres, n'étant ni positivement ni négativement chargées. C'est un attribut important. En raison de leur neutralité, les neutrons peuvent empêcher les protons de se chasser mutuellement du noyau.
En orbite autour du noyau se trouvent les électrons, particules ultra-légères avec des charges négatives. Les électrons facilitent la liaison chimique - et leurs mouvements peuvent produire une petite chose appelée électricité. Les protons ne sont pas moins importants. Pour une chose, ils aident les scientifiques à distinguer les éléments.
Vous avez peut-être remarqué que dans la plupart des versions du tableau périodique, chaque carré a un petit numéro imprimé dans son coin supérieur droit. Ce chiffre est connu sous le nom de numéro atomique. Il indique au lecteur combien de protons se trouvent dans le noyau atomique d'un élément donné. Par exemple, le numéro atomique de l'oxygène est huit. Chaque atome d'oxygène dans l'univers a un noyau avec exactement huit protons; Pas plus, pas moins.
Sans cet arrangement très particulier de particules, l'oxygène ne serait pas de l'oxygène. Le numéro atomique de chaque élément, y compris celui de l'oxygène, est totalement unique. Et c'est un trait déterminant. Aucun autre élément n'a huit protons par noyau. En comptant les protons, vous pouvez identifier un atome. Tout comme les atomes d'oxygène auront toujours huit protons, les atomes d'azote viennent invariablement avec sept. C'est si simple.
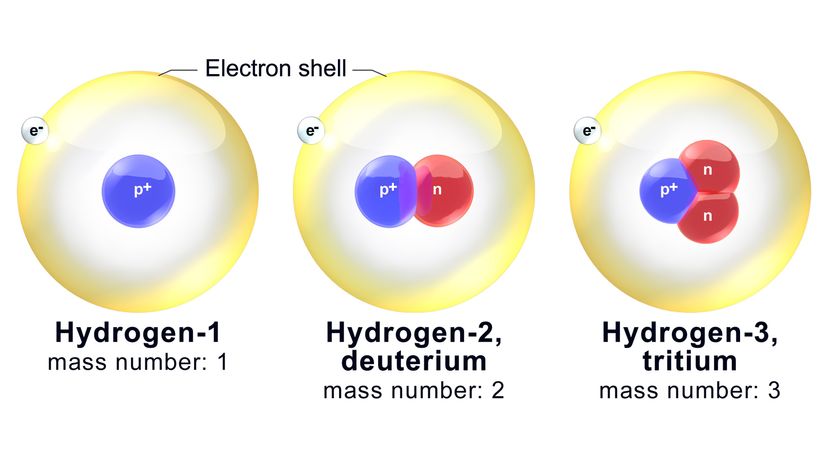
Les neutrons ne suivent pas. Le noyau d'un atome d'oxygène est garanti pour abriter huit protons (comme nous l'avons établi). Cependant, il peut également contenir de quatre à 20 neutrons. Les isotopes sont des variantes du même élément chimique qui ont un nombre différent de neutrons.
Maintenant, chaque isotope est nommé sur la base de son nombre de masse, qui est le nombre total combiné de neutrons et de protons dans un atome. Par exemple, l'un des isotopes de l'oxygène les plus connus s'appelle l'oxygène 18 (O-18). Il a les huit protons standards plus 10 neutrons.
Ergo, le nombre de masse de O-18 est - vous l'avez deviné - 18. Un isotope apparenté, oxygène-17 (O-17), a un neutron de moins dans le noyau.
Certaines combinaisons sont plus fortes que d'autres. Les scientifiques classent O-17 et O-18 comme des isotopes stables. Dans un isotope stable, les forces exercées par les protons et les neutrons se maintiennent ensemble, en gardant en permanence le noyau intact.
D'un autre côté, les noyaux dans les isotopes radioactifs, aussi appelés « radio-isotopes, " sont instables et se désintégreront avec le temps. Ces choses ont un rapport proton-neutron qui est fondamentalement insoutenable à long terme. Personne ne veut rester dans cette situation. Par conséquent, les isotopes radioactifs vont éliminer certaines particules subatomiques (et libérer de l'énergie) jusqu'à ce qu'elles se soient converties en belles, isotopes stables.
O-18 est stable, mais l'oxygène-19 (O-19) ne l'est pas. Ce dernier tombera inévitablement en panne — vite ! Dans les 26,88 secondes suivant sa création, un échantillon d'O-19 est assuré de perdre la moitié de ses atomes à cause des ravages de la décomposition.
Cela signifie que l'O-19 a une demi-vie de 26,88 secondes. Une demi-vie est le temps qu'il faut à 50 % d'un échantillon d'isotope pour se désintégrer. Rappelez-vous ce concept; nous allons le relier à la paléontologie dans la section suivante.
Mais avant de parler de science fossile, il y a un point important qui doit être fait. Contrairement à l'oxygène, certains éléments n'ont aucun isotope stable. Pensez à l'uranium. Dans le monde naturel, il existe trois isotopes de ce métal lourd, et ils sont tous radioactifs, avec les noyaux atomiques dans un état constant de désintégration. Finalement, un morceau d'uranium se transformera en un élément tout à fait différent.
Ne vous embêtez pas à essayer de regarder la transition en temps réel. Le processus se déroule très, très lentement.
Uranium-238 (U-238), l'isotope le plus courant de l'élément, a une demi-vie d'environ 4,5 milliards d'années ! Progressivement, il deviendra plomb-206 (Pb-206), qui est stable. De même, l'uranium-235 (U-235) - avec sa demi-vie de 704 millions d'années - se transforme en plomb-207 (Pb-207), un autre isotope stable.
Aux géologues, ce sont des informations vraiment utiles. Disons que quelqu'un trouve une plaque de roche dont les cristaux de zircon contiennent un mélange d'U-235 et de Pb-207. Le rapport de ces deux atomes peut aider les scientifiques à déterminer l'âge de la roche.
Voici comment :disons que les atomes de plomb sont largement plus nombreux que leurs homologues d'uranium. Dans ce cas, vous savez que vous regardez un joli vieux rocher. Après tout, l'uranium a eu tout le temps de commencer à se transformer en plomb. D'autre part, si le contraire est vrai - et les atomes d'uranium sont plus courants - alors la roche doit être du côté le plus jeune.
La technique que nous venons de décrire est appelée datation radiométrique. C'est l'acte d'utiliser les taux de désintégration bien documentés des isotopes instables pour estimer l'âge des échantillons de roche et des formations géologiques. Les paléontologues exploitent cette stratégie pour déterminer combien de temps s'est écoulé depuis le dépôt d'un fossile particulier. (Bien qu'il ne soit pas toujours possible de dater le spécimen directement.)
Vous n'avez pas besoin d'être un passionné de préhistoire pour apprécier les isotopes. Les médecins utilisent certaines des variétés radioactives pour surveiller le flux sanguin, étudier la croissance osseuse et même lutter contre le cancer. Les radio-isotopes ont également été utilisés pour donner aux agriculteurs un aperçu de la qualité des sols.
Alors voilà. Quelque chose d'aussi abstrait que la variabilité des neutrons affecte tout, du traitement du cancer aux mystères du temps profond. La science est géniale.
MAINTENANT C'EST AMUSANTLe sport et la science se croisent plus souvent que vous ne le pensez. La plus grande ville du Nouveau-Mexique a débarqué une nouvelle équipe de baseball de ligue mineure en 2003. Son nom ? Les isotopes d'Albuquerque. Une référence à un épisode de la saison 12 de "Les Simpson, " le nom inhabituel de l'équipe a eu un effet secondaire agréable :par nécessité, les employés du stade dispensent régulièrement des cours de chimie aux fans curieux.