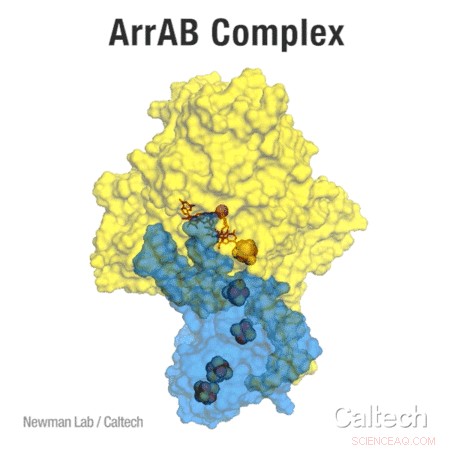
Le complexe ArrAB, l'enzyme qui permet la respiration de l'arséniate, résolu par cristallographie aux rayons X. L'enzyme est composée de deux parties :ArrA représentée en jaune, et ArrB en bleu. Un arc d'amas fer-soufre transfère des électrons - une étape nécessaire du processus de respiration - à un atome d'arsenic par le biais d'un atome de molybdène. Crédit :Avec l'aimable autorisation du laboratoire Newman
L'eau potable contaminée par l'arsenic est un danger majeur pour la santé, avec une exposition chronique causant des maladies et des cancers. L'Organisation mondiale de la santé estime qu'au Bangladesh, par exemple, plus de 5 millions de personnes ont été exposées à de l'eau potable contaminée à l'arsenic en 2009. Souvent, l'arsenic est libéré dans l'eau par les microbes qui respirent, ou respirer, composés contenant de l'arsenic. Les chercheurs de Caltech ont maintenant déterminé la structure de l'enzyme bactérienne qui permet la respiration de l'arsenic. Le travail est une étape importante vers la prédiction des influences biologiques sur la mobilisation de l'arsenic dans l'environnement.
Le travail a été effectué dans le laboratoire de Dianne Newman, le professeur Gordon M. Binder/Amgen de biologie et de géobiologie, la Chaire de leadership Allen V. C. Davis et Lenabelle Davis du Centre pour les interactions microbiennes environnementales de Caltech, et directeur général pour la biologie moléculaire. Il apparaît dans un article du numéro du 13 août de Actes de l'Académie nationale des sciences .
Parmi les composés toxiques contenant de l'arsenic qui contaminent l'eau potable figurent les arséniates. Ces composés sont généralement associés aux minéraux de fer dans les environnements sédimentaires. Sous cette forme, les arséniates ne sont pas susceptibles de se dissoudre dans les eaux souterraines qui s'écoulent à travers ces gisements géologiques. Lorsque les bactéries de ces environnements manquent d'oxygène, ils peuvent entrer dans un mode anaérobie et se transformer en arséniate respiratoire. Ce faisant, les microbes transforment l'arséniate en arsénite, un composé similaire qui est beaucoup plus soluble dans l'eau. De nombreux types de bactéries ont cette capacité, dont la clé est une protéine particulière appelée le complexe enzymatique Arr.
Une équipe internationale de chercheurs dirigée par l'ancien étudiant diplômé de Caltech Nathaniel Glasser (Ph.D. '17) a maintenant déterminé la structure physique de l'enzyme et les emplacements moléculaires précis où elle interagit chimiquement avec l'arséniate.
Les protéines comme le complexe Arr sont si petites qu'elles ne peuvent pas être vues au microscope optique. Ainsi, l'équipe de Caltech s'est tournée vers une technique appelée diffraction des rayons X pour révéler la structure de l'enzyme. Découvrir exactement comment cette enzyme est structurée est important pour comprendre ses fonctions spécifiques, en particulier parce qu'il existe des protéines similaires qui interagissent de différentes manières avec les composés de l'arsenic. En outre, Glasser a pu examiner l'enzyme produite par la bactérie Shewanella - des microbes qui effectuent réellement la respiration de l'arséniate dans l'environnement - plutôt que dans l'organisme couramment utilisé en laboratoire pour l'expression des protéines bactériennes, Escherichia coli (E. coli). Bien que E. colican effectue la respiration de l'arséniate et exprime le complexe enzymatique Arr, Shewanella peut produire des protéines beaucoup plus actives.
La raison pour laquelle l'arséniate est toxique pour l'homme est qu'il est chimiquement similaire au phosphate, un composé nécessaire aux cellules pour fabriquer de l'ATP, la monnaie énergétique de la cellule. S'il y a trop d'arséniate présent, la cellule commence à absorber cela à la place du phosphate, détruire la capacité de la cellule à fabriquer de l'ATP. Dans cette étude, Glasser et ses collègues ont mesuré l'activité de l'enzyme Arr en présence de différents niveaux de phosphate.
"Contrairement à ce que l'on pourrait croire, le phosphate stimule probablement la respiration de l'arséniate plutôt que de l'inhiber dans les environnements sédimentaires typiques en contact avec les eaux souterraines. Sachant à quelle vitesse cette enzyme agit dans des conditions environnementales pertinentes, nous nous rapprochons de la capacité de prédire la quantité de bactéries susceptibles de mobiliser l'arsenic dans l'eau potable à certains endroits, " dit Newman. " Cette recherche ne résoudra pas la crise au Bangladesh, mais avoir une meilleure maîtrise quantitative de ce qui se passe est utile pour résoudre à peu près n'importe quel problème, et particulièrement important lorsqu'on s'attaque à un problème environnemental complexe où de nombreux facteurs sont impliqués. Ce travail fournit des informations utiles sur une enzyme qui, pour autant que nous sachions, se trouve dans chaque bactérie qui respire l'arséniate."
L'article s'intitule "L'analyse structurelle et mécaniste de la réductase respiratoire de l'arséniate donne un aperçu des transformations environnementales de l'arsenic".