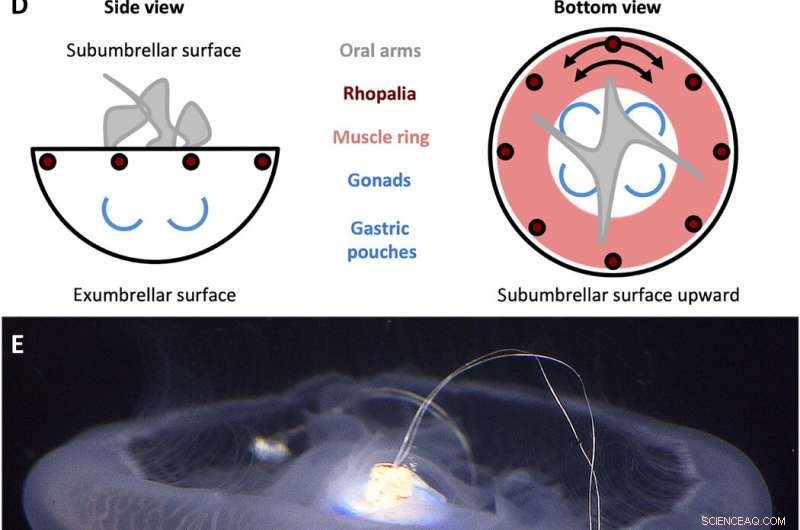
Conception du contrôleur de natation A. aurita. (A) Signal carré généré par le contrôleur de natation avec une amplitude (A) de 3,7 V et une largeur d'impulsion (T) de 10 ms, réglé à des fréquences (f) de 0,25, 0,38, 0,50, 0,62, 0,75, 0,88, et 1,00 Hz. (B) Composants du contrôleur de natation. Le boîtier comprend (i) un capuchon en polypropylène avec une tige en bois qui s'encastre dans le centre de la cloche, et (ii) un film plastique pour imperméabiliser le boîtier, les deux sont compensés par des poids en acier inoxydable et en liège pour maintenir l'appareil à une flottabilité approximativement neutre. La microélectronique comprend (iii) un mini-processeur TinyLily, (iv) une batterie au lithium polymère, et (v) deux électrodes à pointe de platine avec LED pour indiquer visuellement la stimulation. (C) Appareil entièrement assemblé, avec le processeur et la batterie enfermés dans le boîtier. (D) Schémas simplifiés de l'anatomie d'A. aurita, mettre en évidence les surfaces subumbrellar (haut) et exumbrellar (bas), rhopalia, anneau musculaire, et l'orientation circonférentielle des fibres musculaires, bras buccaux, et gonades/poches gastriques. (E) Contrôleur de nage (inactif) embarqué dans une méduse en nage libre, côté sous-ombrelle orienté cloche vers le haut, avec la broche en bois insérée dans le manubrium et deux électrodes enfoncées dans le muscle et le tissu mésoglé près du bord de la cloche. Crédits photo pour (B), (C), et (E) :Nicole W. Xu, Université de Stanford. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz3194
Les chercheurs en matériaux robotiques visent à contrôler artificiellement la locomotion animale pour relever les défis existants en matière d'actionnement, exigences de contrôle et de puissance en robotique douce. Dans un nouveau rapport en Avancées scientifiques , Nicole W. Xu et John O. Dabiri aux départements de bio-ingénierie, Le génie civil et environnemental et le génie mécanique à l'Université de Stanford ont présenté un robot biohybride qui utilisait la microélectronique embarquée pour induire la nage chez des méduses vivantes. Ils ont mesuré la capacité d'améliorer considérablement la propulsion en entraînant des contractions corporelles à une plage de fréquences optimale plus rapidement que le comportement naturel. La manœuvre a augmenté la vitesse de nage de près de trois fois, bien qu'avec seulement une augmentation du double de la dépense métabolique de l'animal et 10 mW d'entrée de puissance externe à la microélectronique. Le robot biohybride utilisait 10 à 1000 fois moins d'énergie externe par masse qu'avec les robots aquatiques précédemment rapportés. La capacité peut améliorer la portée des performances des robots biohybrides par rapport aux performances natives, avec des applications potentielles en tant que robots de surveillance océanique biohybrides.
Les méduses sont un organisme modèle convaincant pour former des véhicules sous-marins économes en énergie en raison de leur faible coût de transport (COT). Les robots biomimétiques existants d'animaux nageurs entièrement construits à partir de matériaux d'ingénierie peuvent atteindre des vitesses comparables à celles des animaux naturels, mais avec des ordres de grandeur moins efficaces que les méduses. Les robots méduses biohybrides peuvent donc intégrer des animaux vivants pour relever les défis existants de la robotique douce. Les chercheurs peuvent utiliser la structure de la méduse pour l'actionnement et résoudre les besoins en énergie en explorant les comportements alimentaires naturels où ils extraient l'énergie chimique des proies in situ. L'approche peut également permettre la guérison des dommages via des processus naturels de cicatrisation inhérents à l'animal, contrôler la locomotion animale et permettre des études supplémentaires de la biomécanique des organismes vivants dans des expériences contrôlées par l'utilisateur. Dans cette étude, Xu et Dabiri ont utilisé un système de microélectronique pour contrôler de l'extérieur une méduse vivante et former un robot biohybride pour faire progresser la science et l'ingénierie de la locomotion aquatique.
Afin d'activer les méduses comme échafaudage naturel, l'équipe a utilisé le métabolisme basal de l'animal pour réduire les besoins énergétiques supplémentaires et a tiré parti de ses muscles pour l'actionnement tout en s'appuyant sur les propriétés d'auto-guérison et de régénération des tissus pour une tolérance accrue aux dommages. L'équipe a émis l'hypothèse que l'augmentation des fréquences de contraction des cloches des méduses pourrait augmenter la vitesse de nage jusqu'à une certaine limite. Ils ont donc contrôlé de manière externe la fréquence des impulsions chez les animaux nageurs en mesurant la vitesse de nage et l'apport en oxygène pour calculer le coût de transport (COT) et tester leur hypothèse de travail. Auparavant, de tels examens n'étaient possibles que par le biais de modèles informatiques ou théoriques.
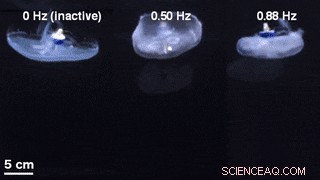
Une comparaison des géométries de cloche pour la nage non stimulée avec un contrôleur de nage inactif intégré (à gauche) et une nage contrôlée de l'extérieur à 0,50 Hz (au milieu) et 0,88 Hz (à droite). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz3194
Xu et al. sélectionné Aurelia aurita comme organisme modèle; une espèce de méduse aplatie contenant une cloche mésogléale flexible et une monocouche de muscles coronaux et radiaux tapissant la surface sous-ombrelle. Pour nager, les organismes ont contracté des muscles pour diminuer le volume de la cavité sous-ombrière et éjecter de l'eau pour fournir une force motrice ainsi que des contributions supplémentaires de la récupération d'énergie passive et de la propulsion par succion. Pour initier ces contractions musculaires, la méduse a activé l'un de ses stimulateurs légers situés dans les organes capteurs appelés rhopalia le long du bord de la cloche. Ces grappes nerveuses ont activé l'ensemble du réseau nerveux moteur pour provoquer des propagations d'ondes musculaires bidirectionnelles provenant des stimulateurs cardiaques activés lors de la propagation naturelle.
Intégration de la conception robotique dans les méduses vivantes et validation de l'appareil
Les scientifiques ont d'abord conçu un portable, contrôleur de natation microélectronique autonome pour générer une onde de pouls carrée et stimuler les contractions musculaires de 0,25 Hz à 1,00 Hz. Ils ont composé le contrôleur avec un mini-processeur TinyLily et une cellule lithium polymère de 10 mAh. Pour confirmer visuellement le signal électrique, Xu et al. connecté les fils en série aux diodes électroluminescentes (DEL) TinyLily. Ils ont ensuite inséré des électrodes bilatéralement dans le tissu sous-ombrelle et ont maintenu le système naturellement flottant avec des rondelles en acier inoxydable et du liège. Pour valider que le contrôleur de natation pouvait contrôler de manière externe les contractions des cloches des méduses, les scientifiques ont développé une méthode pour suivre le mouvement de la marge de la cloche. Pour ça, ils ont réalisé trois séries d'expériences, (1) d'observer les contractions endogènes de l'organisme en l'absence de toute perturbation, (2) pour observer si l'intégration mécanique des électrodes inactives affectait le comportement naturel de l'animal et (3) pour tester les protocoles de stimulation pour confirmer les contractions externes.
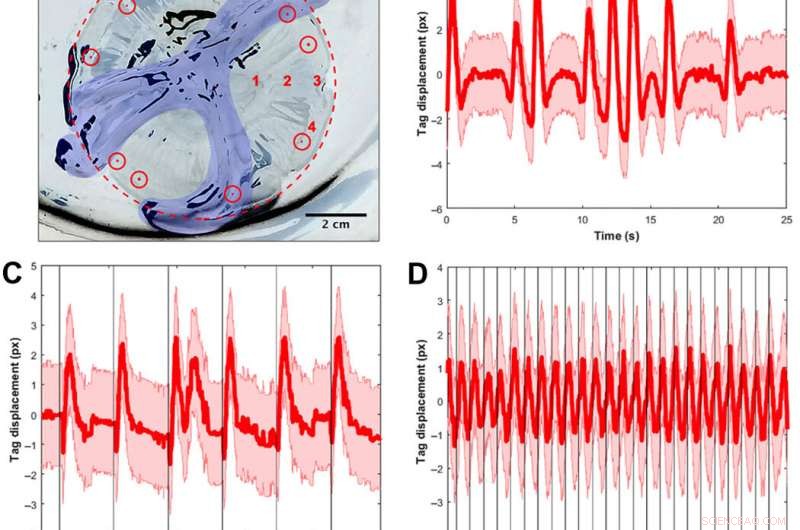
Validation du signal à l'aide de balises visuelles et de spectres de fréquence pour suivre les contractions musculaires. (A) A. aurita medusae (n =10, 8,0 à 10,0 cm de diamètre) ont été placés à la surface sous-ombrelle dans une plaque sans eau de mer pour des expériences de stimulation musculaire contrainte (électrode non représentée). L'image est inversée pour que la cloche et la plaque soient blanches, et les zones noires sont les reflets de la lumière provenant des tissus animaux et de la plaque. Pour plus de clarté, la marge de la cloche est cernée d'un cercle pointillé rouge, et les bras oraux sont colorisés en bleu. Des étiquettes en élastomère d'implant visibles (présentées sous forme de points rouges colorés dans des cercles rouges) ont été injectées autour de la marge, et une étiquette a été suivie par vidéo pour calculer le déplacement des tissus en tant que substitut des contractions musculaires. Des tests spatiaux visant à déterminer si l'emplacement des électrodes affectait les spectres ont été effectués à quatre emplacements, étiquetés en chiffres rouges :(1) adjacents aux poches gastriques, (2) à mi-chemin entre les poches gastriques et la marge, (3) à la rhopalia, et (4) à la marge éloignée de la rhopalia. Tous les autres tests ont été effectués à l'emplacement 2. (B) Exemple de déplacement d'étiquette en fonction du temps pour un animal sans aucun stimulus externe. La ligne rouge indique le déplacement du centre de gravité, avec l'erreur calculée en supposant une incertitude d'un demi-pixel pour trouver le centroïde de l'étiquette dans chaque image, plus de 25 s. Notez la variation temporelle des contractions musculaires, y compris des périodes d'impulsions régulières et d'impulsions rapides successives. (C) Exemple de déplacement de balise pour un animal avec un stimulus externe de 0,25 Hz, avec chaque stimulus visualisé comme une ligne noire verticale. Bien que les contractions suivent régulièrement des stimuli externes, les impulsions animales naturelles se produisent également à de basses fréquences. Noter, par exemple, la double impulsion après un stimulus (t 12 s). (D) Exemple de déplacement de balise pour un animal avec un stimulus externe de 1,00 Hz, avec chaque stimulus visualisé comme une ligne noire verticale. La même fenêtre temporelle (25 s) est affichée pour une comparaison équitable avec les deux tracés précédents. Les contractions suivent régulièrement des stimuli externes. (E) spectre d'amplitude unilatéral (SSAS) moyenné pour les méduses sans aucun stimulus externe (n =12 pour 10 animaux, c'est à dire., 2 méduses avaient chacune deux clips répliqués). La ligne rouge indique la moyenne du SSAS normalisé pour chaque réplicat, avec le SD en rose. Le pic du SSAS moyen est à 0,16 Hz. La pleine largeur à mi-hauteur (FWHM) est de 0,24 Hz. (F) Réponse des méduses à une électrode inactive intégrée (n =14 pour 10 animaux, c'est à dire., 4 méduses avaient chacune deux clips répliqués). Le pic du SSAS moyen est à 0,18 Hz. Le FWHM est de 0,16 Hz. En utilisant un test t à deux échantillons des fréquences de crête pour les deux groupes, la différence entre les deux échantillons était statistiquement non significative (P =0,68). (G) Échantillon SSAS pour un stimulus électrique à 1,00 Hz (n =10 méduses pour un signal d'entrée de 4,2 V et 4,0 ms). La fréquence de crête se produit à 1,02 Hz, dans la fenêtre de 0,02 utilisée pour calculer le SSAS. Notez que le spectre a un pic plus net à la fréquence d'intérêt (FWHM de 0,04 Hz), par opposition à une FWHM plus large en (B) et (C), les cas sans aucun stimulus externe. (H) Carte de contour de la réponse en fréquence des contractions musculaires aux stimuli électriques externes. Chaque ligne verticale de données (centrée sur des lignes blanches à 0,25, 0,50, 0,75, 1,00, 1,20, 1,50, et 2,00 Hz) représente la PSD à une fréquence d'entrée électrique, avec le nombre de méduses testées indiqué ci-dessus. Les couleurs correspondent à l'amplitude du PSD, dans lequel les valeurs supérieures sont affichées en jaune et les valeurs inférieures en bleu. La ligne rouge continue représente une réponse d'entrée-sortie un-à-un, et la ligne rouge en pointillés représente la limite physiologique rapportée selon la période réfractaire absolue minimale du muscle A. aurita (32). Les essais réactifs sont définis par le fait que les fréquences de crête dans la PSD se situent dans une fenêtre de 0,06 Hz de la courbe rouge continue. (I) Cartes de contour des essais qui ne répondent pas. Des fréquences plus élevées jusqu'à 90,00 Hz ont également été testées avec des PSD similaires ne répondant pas. Crédit photo pour (A) :Nicole W. Xu, Université de Stanford. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz3194
Ils ont constaté que le comportement animal naturel (ou contraction endogène) était irrégulier avec une variabilité élevée de la fréquence du pouls, y compris une fréquence de crête moyenne de 0,16 Hz. Une électrode inactive n'a pas modifié significativement les spectres de fréquence, tandis que les contractions externes ont montré une limite physiologique des contractions musculaires des méduses entre 1,4 Hz et 1,5 Hz. L'équipe a mené des essais de nage avec le système implanté dans un réservoir d'eau salée et a normalisé les vitesses de nage mesurées pour tenir compte de la variation de la taille des animaux. Ils ont mis à l'échelle la vitesse de nage normalisée par la moyenne de la vitesse normalisée en l'absence de stimulation (c'est-à-dire 0 Hz) pour déterminer le facteur d'amélioration. Le facteur d'amélioration maximal était jusqu'à 2,8 fois la vitesse de nage naturelle des animaux, c'est à dire., la vitesse de nage augmentée jusqu'à 2,8 fois grâce à la microélectronique embarquée.
Consommation d'énergie de l'appareil très efficace
Les méduses artificiellement contrôlées nécessitaient une alimentation externe du système microélectronique et une alimentation interne provenant du propre métabolisme des animaux. Lorsqu'il est conduit à des fréquences croissantes, le système microélectronique de la méduse robotique biohybride a consommé plus de watts par kg. Cependant, par rapport aux robots existants, ce robot biohybride utilisait jusqu'à 1000 fois moins d'énergie externe. Xu et al. a comparé ce prototype avec le rayon médusoïde et robotique fabriqué à partir de cardiomyocytes de rat ensemencés sur des échafaudages en silicium, et avec des robots purement mécaniques ainsi que des véhicules sous-marins autonomes (AUV). En plus des avantages économiques de la faible consommation d'énergie externe par masse du robot biohybride, le système microélectronique ne coûte que moins de 20 $ à partir de composants disponibles dans le commerce. L'électrolocalisation était également non spécifique et les animaux se sont immédiatement rétablis après les expériences.
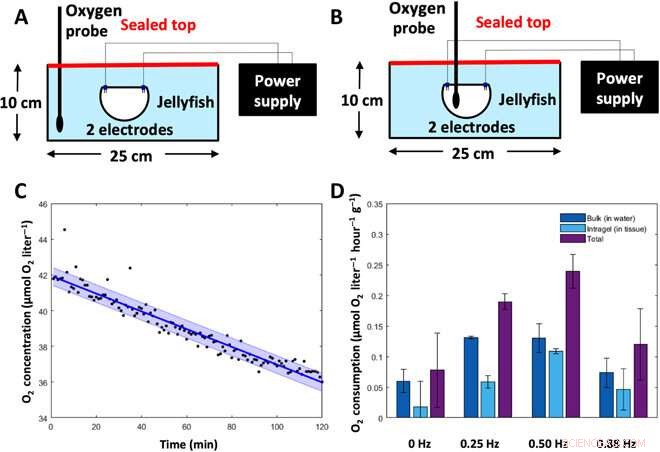
Metabolic rate experiments. To determine the metabolic rate of jellyfish, oxygen concentrations were measured in animal tissue and the surrounding water and then converted into energy expenditure. (A) Experimental setup to measure bulk dissolved oxygen concentrations (in the water). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Oxygen levels in the water were measured using a MicroOptode oxygen probe. (B) Experimental setup to measure intragel oxygen concentrations (in the tissue). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Intragel oxygen levels were measured using a MicroOptode oxygen probe embedded into the tissue. (C) Representative plot of oxygen concentrations over time, measured from the MicroOptode. This example shows measurements of bulk oxygen levels in the water surrounding an animal with a swim controller–driven frequency of 1.00 Hz. Individual data points are shown in black, the best-fit line is shown in dark blue, and the SD is shown in the light blue shaded region. (D) Oxygen consumption rates of the surrounding water (dark blue), within animal tissue (light blue), and total (sum of the water and tissue measurements, purple) were calculated over a 6- to 8-hour period (n =7 animals).Credit:Science Advances, doi:10.1126/sciadv.aaz3194
The new capability of external control allowed Xu et al. to address the relationship between swimming frequency and metabolic rate. Oxygen consumption rates followed a similar pattern to enhanced swimming speeds, and the scientists calculated the equivalent cost of transport using both experimental metabolic rates and experimental swimming speeds. The COT increased at mid-range frequencies and decreased at high external stimulation frequencies. The results showed that enhanced jellyfish swimming did not cause undue cost to the metabolism or health of the animal.
The main robotic limit of the study was the power requirement of the microelectronic system relative to animal versus microelectronic power needs. Further improvement to microelectronics can decrease the energetic costs and extended studies can also strive to minimize endogenous animal contractions without harming the organism to improve controllability of live-animal-based biohybrid robots. The artificial control of jellyfish can expand ocean monitoring techniques with improved controllability by incorporating microelectronic sensors to leverage the existing tagging technology.
© 2020 Réseau Science X