
Photo des chercheurs, avec (de gauche à droite) :Dr Hen Dotan, Avigail Landman, Pr Avner Rothschild, Prof. Gideon Grader. Crédit :Chen Galili, Département porte-parole du Technion.
La production électrolytique d'hydrogène implique la génération d'hydrogène à partir de l'eau en utilisant l'énergie électrique, qui devrait idéalement provenir de sources d'énergie renouvelables telles que la lumière du soleil et le vent. Bien que cette méthode de production d'hydrogène puisse être une solution très prometteuse pour accroître la durabilité, mais les chercheurs devront surmonter plusieurs défis clés pour qu'il se généralise.
Dans une étude récente publiée dans Énergie naturelle , une équipe de chercheurs du Technion-Israel Institute of Technology a relevé certains de ces défis, présentant une nouvelle technique de fractionnement de l'eau qui pourrait améliorer les méthodes existantes de production d'hydrogène électrolytique. Leurs recherches s'inspirent d'une de leurs précédentes études sur la séparation photoélectrochimique (PEC) de l'eau, dans lequel ils ont essayé de combiner l'énergie solaire et la (photo)électrolyse de l'eau pour générer de l'hydrogène à partir de la lumière du soleil et de l'eau.
L'un des plus grands défis décrits dans ce travail précédent était la collecte d'hydrogène gazeux à partir de millions de cellules PEC réparties dans le champ solaire. Dans leur étude, les chercheurs basés au Technion ont essayé de développer une technique capable de relever efficacement ce défi.
« En prenant les centrales solaires photovoltaïques (PV) comme scénario de base, la ferme solaire est composée de millions de cellules PV individuelles, où le courant (et la tension) est collecté de chacun d'eux dans une grille métallique, " Avner Rothschild, l'un des chercheurs qui a mené l'étude, a déclaré TechXplore. "C'est facile avec l'électricité, mais pas avec l'hydrogène gazeux."
Dans une centrale solaire PEC idéale du futur, Les cellules PV seraient remplacées par des cellules PEC, qui peut produire de l'hydrogène dans un composant appelé compartiment cathodique, et de l'oxygène dans une chambre séparée appelée compartiment anodique. Ces deux compartiments doivent être séparés, à tout le moins par une membrane, afin de s'assurer que l'hydrogène et l'oxygène ne se mélangent pas, car cela provoquerait une explosion. En outre, l'hydrogène gazeux doit être collecté à partir de chaque cellule individuelle.
La création de cette configuration s'est jusqu'à présent avérée techniquement difficile et coûteuse, car il nécessite un collecteur de tuyauterie très coûteux. Finalement, cela a rendu irréaliste la réalisation de solutions pour la production d'hydrogène à grande échelle par séparation de l'eau PEC.
"Nous avons cherché un moyen de sortir de ce défi, et a eu l'idée de séparer les compartiments oxygène et hydrogène de la cellule PEC en deux cellules distinctes, de sorte que l'oxygène est généré dans le champ solaire et est rejeté dans l'atmosphère, alors que l'hydrogène est généré dans un réacteur central au coin du champ, " dit Rothschild. " La séparation en deux cellules est rendue possible en insérant un autre jeu de deux électrodes, appelées électrodes auxiliaires, qui sont chargés et déchargés simultanément par OH - les ions impliqués dans la réaction de séparation de l'eau, assurant ainsi la médiation de l'échange d'ions entre les deux cellules (ce qui est nécessaire pour fermer le circuit électrique)."
Dans leur précédent article, Publié dans Matériaux naturels , Rothschild et ses collègues ont présenté une nouvelle approche perturbatrice pour les architectures d'électrolyse de l'eau (électrolyseurs) et de photoélectrolyse (PEC). Cette approche prometteuse, cependant, introduit un autre défi consistant à régénérer les électrodes auxiliaires lorsqu'elles sont saturées à la fin d'un cycle de production. Les chercheurs ont suggéré que les électrodes pourraient être échangées à la fin de chaque cycle, mais ce serait assez lourd, ils ont donc continué à explorer des solutions alternatives.
« Nous avons alors découvert que lorsque vous chauffez l'électrode auxiliaire dans la pile à hydrogène, après avoir été chargé (pour devenir NiOOH), il libère spontanément des bulles d'oxygène gazeux et se régénère à son état initial (Ni(OH)
E-TAC, la nouvelle technique de séparation d'eau proposée par Rothschild et ses collègues, a une efficacité énergétique élevée de 98,7 pour cent, par conséquent, il surpasse considérablement les électrolyseurs conventionnels, qui ont généralement une efficacité énergétique d'environ 70 à 80 % pour les appareils de pointe. Un autre avantage de l'E-TAC est qu'il produit de l'hydrogène et de l'oxygène de manière séquentielle, tandis que dans la plupart des autres électrolyseurs, ils sont produits simultanément. Cela élimine finalement le besoin d'une membrane séparant les gaz hydrogène et oxygène, simplifiant ainsi grandement la construction et l'assemblage des cellules, ainsi que leur exploitation et leur entretien.
"Potentiellement, cela pourrait se traduire par d'importantes économies sur les coûts d'investissement et d'exploitation, conduisant au développement d'une technologie de fractionnement de l'eau rentable qui peut concurrencer le SMR (reformage du méthane à la vapeur), proposer de l'hydrogène pas cher sans CO
Dans l'électrolyse conventionnelle de l'eau, l'hydrogène et l'oxygène sont toujours produits simultanément dans les compartiments cathodique et anodique, respectivement. Les compartiments sont placés au plus près les uns des autres, pour minimiser les pertes ohmiques électriques, et ils sont séparés par une membrane pour éviter la création d'un H explosif
"La cathode réduit l'eau, produire de l'hydrogène (H
Dans l'électrolyse conventionnelle de l'eau, les deux réactions électrochimiques décrites par Rothschild sont couplées dans le temps et dans l'espace, car ils se produisent simultanément, dans la même cellule et à proximité. De plus, ces caractéristiques sont les mêmes que le procédé soit appliqué à des électrolyseurs alcalins ou PEM.
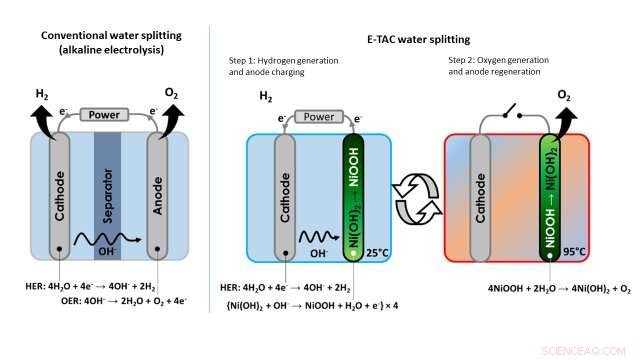
Image montrant la différence entre l'approche conventionnelle de la séparation de l'eau (électrolyse alcaline) et la technique de séparation de l'eau E-TAC proposée par les chercheurs. Crédit :Dotan et al.
Contrairement à cette approche traditionnelle de l'électrolyse de l'eau, le procédé de séparation de l'eau imaginé par les chercheurs découple les réactions HER et OER, qui se produisent plutôt à des moments différents et potentiellement dans différentes parties d'un appareil. Plutôt que d'être continu, donc, E-TAC peut être décrit comme un « processus par lots » avec deux cycles, le premier générant de l'hydrogène électrochimiquement et le second de l'oxygène via une réaction chimique spontanée.
"Nous plaçons la cathode (la même cathode utilisée en électrolyse alcaline) et l'anode (qui est différente de l'anode en électrolyse classique) dans une cellule d'électrolyse et faisons passer du courant entre elles, " dit Rothschild. " La cathode génère de l'hydrogène par la réaction HER, tout comme dans le cas de l'électrolyse de l'eau conventionnelle, mais l'anode fait une chose complètement différente. L'anode se charge essentiellement en absorbant l'OH
-
les ions générés à la cathode, et transformer progressivement de Ni(OH)
De façon intéressante, la réaction produite dans l'anode est la même que celle qui se produit à la cathode des piles alcalines (par exemple les piles Ni-MH) pendant qu'elles se chargent. Cela suggère qu'il peut bien fonctionner pendant de nombreux cycles, tout comme il le fait dans les piles alcalines.
Parfois, cependant, la charge de l'anode dans le processus E-TAC doit être interrompue, parce que s'il est surchargé, il pourrait commencer à générer de l'oxygène. Lorsque la charge dépasse un certain niveau, donc, les chercheurs doivent limiter la tension appliquée aux cellules pour éviter d'éventuelles explosions dérivées de la cogénération d'oxygène et d'hydrogène.
« Afin de poursuivre le processus E-TAC, nous devons ensuite régénérer l'anode chargée (NiOOH) à son état initial (Ni(OH)
The technique devised by Rothschild and his colleagues thus entails the use of heat to control the chemical reaction that generates oxygen, as the rate of the reaction slows down at low temperatures and accelerates at high temperatures. The generation of hydrogen occurs at a low or ambient temperature, and the generation of oxygen at high temperatures around 95 degrees Celsius. This is why the researchers decided to call it the E-TAC process, which stands for electrochemical-thermally activated chemical process.
"In the proof-of-concept lab tests presented in our article, we manually moved the anode from the cold cell (i.e. a glass beaker filled with alkaline aqueous solution at ambient temperature) to the hot cell (i.e. the same type of beaker, but heated to 95 degrees Celsius), so the separation between hydrogen and oxygen generation was not only in time but also in place, " Rothschild explained. "However, in a real-world industrial system, we foresee a different scenario in which the two electrodes (anode and cathode) and stationary (not moving), whereas the cell in which they are is filled sequentially with cold or hot electrolyte solutions."
Separating the production of hydrogen and oxygen, which removes the need for a membrane separating the two different chambers inside electrolytic cells, results in substantial savings over traditional electrolysis approaches. En réalité, sealing the membrane is generally expensive and also complicates the overall production process. The membrane in conventional systems requires high-purity water and ongoing maintenance, all of which are unnecessary in E-TAC.
En outre, the technique devised by Rothschild and his colleagues entirely eliminates the risk of volatile encounters between oxygen and hydrogen, as well as resulting explosions. In traditional systems, d'autre part, this risk is still present, as the membrane could rip or its seal could break.
"Actuellement, the use of membranes also limits the pressure in hydrogen production, " Rothschild said. "E-TAC renders the membrane unnecessary, thus facilitating hydrogen production under much higher pressure and eliminating some of the high costs of compressing the hydrogen later. De plus, in the new process we proposed, oxygen is produced via a spontaneous chemical reaction between the charged anode and the water, without using an electrical current. This reaction eliminates the need for electricity during oxygen production and increases energetic efficiency from ~70 to 80 percent using customary methods to an unprecedented 98.7 percent."
The technique developed by Rothschild and his colleagues could lower operating costs of sustainable hydrogen production and equipment costs. The researchers have estimated that the production costs for equipment based on E-TAC would be approximately half of those for existing technologies.
"The process we invented presents a conceptual breakthrough in water splitting, and in view of the advantages it offers, it may become a game-changer and lead to a new technology for hydrogen production from water without CO
After they finished writing their paper, the researchers at Technion patented their invention and founded a start-up called H
"We also plan to carry out further academic research to study new electrode materials and apply advanced analytical methods to understand the correlations between electrode composition and microstructure and its function properties, in order to develop the next generation of Ni(OH)
© 2019 Réseau Science X