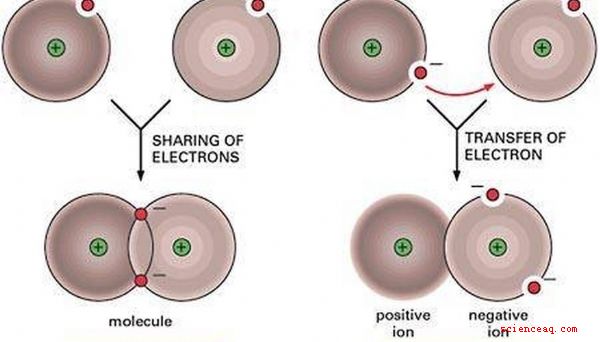
Une liaison moléculaire ou covalente se forme lorsque les atomes se lient en partageant des paires d'électrons. Ce partage peut se produire d'un atome à l'autre ou d'un atome à une autre liaison moléculaire.
Types
Il existe deux types de liaisons moléculaires: les liaisons polaires et les liaisons non polaires. Dans les liaisons polaires, la liaison moléculaire est inégalement partagée entre les atomes; dans les liaisons non polaires, les électrons sont partagés également entre les deux atomes.
Caractéristiques
Les liaisons moléculaires sont classées en liaisons singulières ou en liaisons multiples. Les liaisons moléculaires forment des liaisons simples, où deux atomes partagent seulement une paire d'électrons.
Obligations moléculaires multiples
La double liaison se compose de deux paires d'électrons, une triple liaison se compose de trois paires et les liaisons quadruples se partagent quatre paires d'électrons; il existe également des liaisons quintuple et sextuple.
Liaison covalente coordonnée
Dans une liaison covalente coordonnée, une liaison covalente ou moléculaire se forme lorsqu'un seul des deux atomes est responsable de la fourniture des deux électrons.
Liaison disulfure
Une liaison disulfure est une liaison moléculaire qui se forme lorsque deux atomes de sulfure sont liés pour former des chaînes polypeptidiques dans les protéines.
Obligations à haute énergie
Libération des liaisons à haute énergie niveaux d'énergie élevés lorsque la liaison subit une hydrolyse.
Liaisons ioniques
Les liaisons ioniques provoquent le transfert d'électrons d'un atome à un autre, le laissant avec une charge négative.