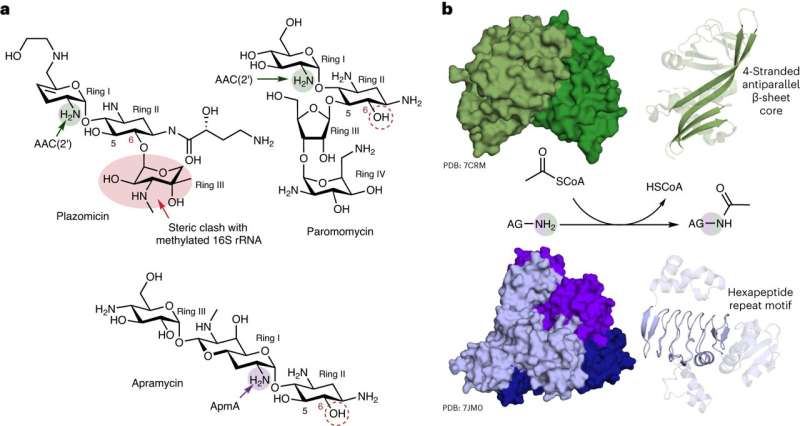
Des chercheurs de l'Université McMaster ont découvert les caractéristiques uniques d'un mécanisme utilisé par les bactéries pour résister à une classe importante d'antibiotiques. La nouvelle recherche, publiée dans Nature Chemical Biology , montre que la résistance aux médicaments aminosides, utilisés pour traiter diverses infections, est beaucoup plus complexe qu'on ne le pensait initialement.
Le chercheur principal Gerry Wright, professeur de biochimie et de sciences biomédicales à McMaster, affirme que son laboratoire a observé une polyvalence jamais vue auparavant chez ApmA, un gène de résistance bactérienne étudié depuis longtemps. La recherche a montré que le gène peut, de manière inhabituelle, permettre aux bactéries de remplir différentes fonctions contre différents antibiotiques.
Parmi la centaine d'enzymes de résistance aux aminoglycosides connues des chercheurs, Wright affirme que seule celle-ci a fait preuve d'un comportement aussi agile.
"C'est une licorne", dit-il. "Il a une apparence différente, il fonctionne différemment et il appartient à une famille d'enzymes totalement différente. Il est complètement différent de tous les mécanismes de résistance que nous associons à cette classe d'antibiotiques."
Wright, membre de l'Institut Michael G. DeGroote pour la recherche sur les maladies infectieuses, affirme que les aminosides ont été parmi les premiers antibiotiques présentant une pertinence clinique et les tout premiers à être utiles contre la tuberculose. Mais comme ils sont prescrits depuis les années 1940, il affirme que « la résistance à ces produits est devenue un véritable problème » – sauf dans le cas de l'apramycine.
"L'antibiotique apramycine évite la plupart des mécanismes de résistance et constitue donc un candidat sérieux pour de nouvelles applications cliniques", dit-il. "Malheureusement, ce mécanisme que nous avons étudié n'est pas un mécanisme que le médicament peut éviter."
Wright affirme que la récente découverte de son laboratoire est importante car l'apramycine fait actuellement l'objet d'essais cliniques et, si elle aboutit, il sera crucial de bien comprendre comment les bactéries pourraient résister au médicament pour étendre son utilité.
"Si nous voulons commercialiser ce médicament, nous ferions mieux de savoir quel est l'ennemi", dit-il. "En savoir plus sur ce mécanisme de résistance unique pourrait éclairer les recherches ultérieures sur l'apramycine de nouvelle génération ou les diagnostics susceptibles de détecter l'ApmA dans les bactéries."
Plus d'informations : Emily Bordeleau et al, La plasticité mécanistique de l'ApmA permet la promiscuité des aminosides pour la résistance, Nature Chemical Biology (2023). DOI :10.1038/s41589-023-01483-3
Informations sur le journal : Nature Chimie Biologie
Fourni par l'Université McMaster