Crédit :Wiley
Indoles, et les structures qui en dérivent, sont un composant de nombreuses substances naturelles, comme le tryptophane, un acide aminé. Une nouvelle réaction catalytique produit des cyclopenta[ b ] indoles - des cadres constitués de trois anneaux qui se rejoignent sur les bords - de manière très sélective et avec la structure spatiale souhaitée. Comme une équipe de recherche rapporte dans la revue Angewandte Chemie , les vitesses des différentes étapes de la réaction jouent un rôle critique.
Les dérivés d'indole sont largement répandus dans la nature; ils font partie de la sérotonine et de la mélatonine, ainsi que de nombreux alcaloïdes, dont certains sont utilisés comme médicaments, par exemple, comme traitement de la maladie de Parkinson. L'indole est un cycle aromatique à six chaînons fusionné à un cycle à cinq chaînons le long d'un bord. Le cycle à cinq chaînons a une double liaison et un atome d'azote. Le cadre indole de base peut être équipé d'une variété de groupes latéraux ou lié à des anneaux supplémentaires. L'indole et de nombreux dérivés de l'indole peuvent être fabriqués par une réaction de synthèse d'indole développée par et nommée d'après Emil Fischer (condensation assistée par acide de cétones avec des phénylhydrazines).
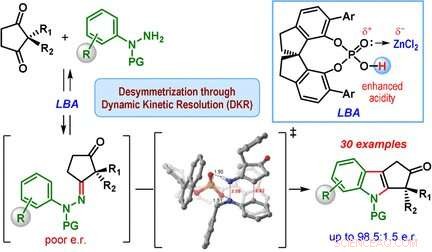
La classe la plus importante de dérivés d'indole sont les cyclopentane[ b ]indoles - des molécules avec une structure constituée d'une unité indole et d'un cycle supplémentaire à cinq chaînons. Ce cycle à cinq chaînons peut contenir un centre carboné chiral, qui est un carbone cyclique qui a deux groupes latéraux supplémentaires, et il peut être arrangé de deux manières qui sont des images miroir l'une de l'autre. Un seul des deux énantiomères, ou des images en miroir, se trouve dans la nature. Cependant, la synthèse classique d'indole de Fischer produit un mélange des deux énantiomères.
Une équipe dirigée par Santanu Mukherjee et Garima Jindal à l'Indian Institute of Science, Bangalore (Inde) a maintenant développé une version catalytique de la synthèse d'indole de Fischer qui produit principalement l'un des énantiomères (c'est-à-dire, la réaction est énantiosélective). Les matières premières sont une classe de dicétones (2, cyclopentane-1 2-disubstitué, 3-diones) et les dérivés de phénylhydrazine équipés de groupes protecteurs spéciaux. Le secret de leur succès est un catalyseur spécial :un chiral, acide phosphorique cyclique. La réaction est effectuée en présence de chlorure de zinc comme co-catalyseur et d'une résine échangeuse de cations acide, qui capture l'ammoniac qui se forme comme sous-produit.
Le cœur du mécanisme réactionnel est appelé résolution cinétique dynamique. Au cours de la réaction, une hydrazone chirale est d'abord formée comme intermédiaire dans les deux formes énantiomères. Cette étape est réversible, de sorte que les deux hydrazones énantiomères puissent s'interconvertir au cours de la réaction. La réaction des hydrazones pour produire les dérivés d'indole est la véritable réaction catalytique. Cette réaction est beaucoup plus rapide pour l'un des énantiomères d'hydrazone par rapport à l'autre car une forme a une géométrie plus favorable lors de la liaison au catalyseur chiral. L'autre énantiomère hydrazone réagit très lentement et ne conduit qu'à une faible quantité de produit indole. Au lieu, l'énantiomère d'hydrazone à réaction lente se convertit en l'énantiomère d'hydrazone à réaction rapide, amenant finalement l'équilibre à se déplacer vers le produit cyclopentane[ b ] indole.
Cette méthode a permis à l'équipe de produire de nombreux dérivés d'indole différents avec des rendements modérés, mais avec une sélectivité énantiomérique bonne à excellente.