Des scientifiques de l'Université de Bath se sont inspirés de la nature pour développer un nouvel outil qui aidera les chercheurs à développer de nouveaux traitements pharmaceutiques d'une manière plus propre, plus écologique et moins coûteuse.
Les traitements médicamenteux agissent souvent en se liant aux protéines impliquées dans la maladie et en bloquant leur activité, ce qui réduit les symptômes ou traite la maladie.
Plutôt que d'utiliser de petites molécules conventionnelles comme médicaments, qui ne sont pas bien adaptées pour bloquer les interactions entre protéines, l'industrie pharmaceutique étudie désormais la possibilité de fabriquer des médicaments utilisant de petites protéines appelées « peptides », qui fonctionnent de manière similaire.
Cependant, les peptides et les protéines ne constituent souvent pas de très bons médicaments car leurs structures 3D peuvent se défaire, ils sont sensibles aux températures élevées et peuvent être difficiles à pénétrer à l'intérieur des cellules du corps, où se trouvent de nombreuses cibles médicamenteuses passionnantes mais difficiles. P>
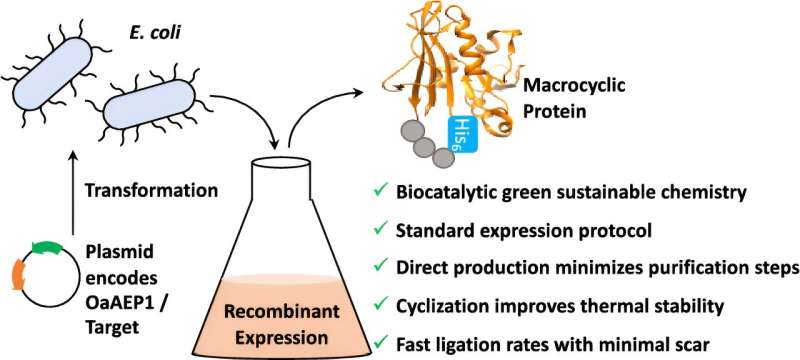
Aujourd’hui, des scientifiques de l’Université de Bath ont mis au point un moyen de contourner ce problème ; normalement, les protéines et les brins peptidiques ont un début et une fin. En réunissant ces extrémités libres, il est possible de créer des protéines et des peptides « cycliques » très rigides, ce qui améliore la stabilité thermique et chimique et facilite leur introduction dans les cellules. .
Ils ont pris une enzyme appelée OaAEP1 d’Oldenlandia affinis, une petite fleur violette qui pousse sous les tropiques, et l’ont modifiée avant de la transférer dans des cellules bactériennes. Ces cultures bactériennes ont été cultivées pour produire en masse une protéine tout en joignant simultanément les extrémités en une seule étape.
Les plantes peuvent effectuer ce processus naturellement, mais il est lent et à faible rendement. Alternativement, la cyclisation peut être effectuée chimiquement en isolant l'enzyme puis en mélangeant plusieurs réactifs dans un tube à essai, mais cela nécessite plusieurs étapes et utilise des solvants chimiques toxiques.
Placer l’ensemble du processus dans un système bactérien augmente le rendement, utilise des réactifs plus durables et biologiquement respectueux et nécessite moins d’étapes. C'est donc beaucoup plus simple et moins cher.
Pour démontrer cette approche, les scientifiques ont appliqué leur technologie bactérienne OaAEP1 à une protéine appelée DHFR et ont découvert que l'assemblage de ses extrémités de tête et de queue la rendait plus résistante aux changements de température tout en conservant sa fonction normale.
Le professeur Jody Mason, du département des sciences de la vie de l'université de Bath, a déclaré :"Les protéines et les peptides sont généralement assez sensibles à la chaleur, mais la cyclisation les rend beaucoup plus robustes."
"La plante Oldenlandia produit naturellement des protéines cycliques dans le cadre d'un mécanisme de défense visant à dissuader les prédateurs."
"Nous avons donc exploité ce super pouvoir de la fleur en modifiant OaAEP1 et en le combinant avec la technologie existante de production de protéines bactériennes pour créer un outil vraiment puissant qui aidera l'industrie de la découverte de médicaments."
Le Dr Simon Tang, associé de recherche au Département des sciences de la vie de l'Université de Bath, a déclaré :« Les protéines et les peptides sont des candidats médicaments très prometteurs, mais un goulot d'étranglement important pour le développement de nouveaux traitements thérapeutiques est la production de suffisamment de substances pour atteindre patients sans encourir un coût astronomique."
"Notre nouveau procédé laisse les bactéries faire tout le travail. Le résultat est également plus propre et plus écologique, et comme il comporte moins d'étapes, il est beaucoup plus simple à réaliser."
"Nous sommes vraiment enthousiasmés par les applications potentielles de ce produit, non seulement pour l'industrie pharmaceutique, mais aussi pour d'autres industries telles que l'industrie alimentaire, l'industrie des détergents, la biotechnologie et la production de bioénergie."
Les chercheurs ont déposé un brevet pour la technique et publié leurs travaux dans la revue JACS Au .
Plus d'informations : T. M. Simon Tang et al, Application intracellulaire d'une asparaginyl endopeptidase pour la production de protéines cycliques tête-à-queue recombinantes, JACS Au (2023). DOI:10.1021/jacsau.3c00591
Fourni par l'Université de Bath