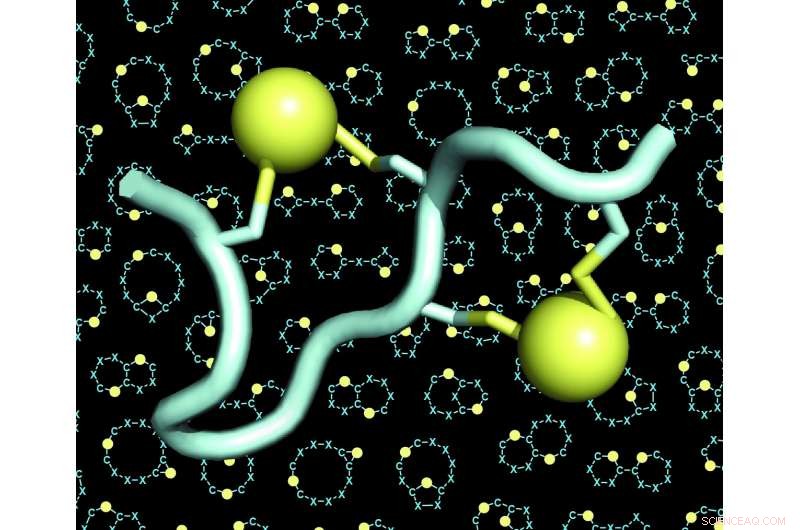
Un modèle d'un peptide à double pont (le peptide en bleu clair, les deux ponts en jaune). L'arrière-plan des figures montre de nombreux exemples de squelettes (également appelés « échafaudages » ou « épines dorsales ») de peptides à double pont. Crédit :C. Heinis/EPFL
Les peptides sont de courtes chaînes d'acides aminés qui peuvent se lier aux protéines et modifier leur fonction. Ils montrent une affinité de liaison élevée, faible toxicité, et sont faciles à synthétiser, tout cela rend les peptides idéaux pour une utilisation dans le développement de médicaments, et de nombreux peptides naturels tels que l'insuline, l'ocytocine, la somatostatine et les antibiotiques vancomycine ou polymyxine B, sont largement utilisés.
Cependant, l'utilisation de peptides comme médicaments fait face à deux défis. D'abord, affinité de liaison :une bonne liaison nécessite des architectures peptidiques difficiles et des séquences d'acides aminés parfaitement complémentaires en forme et en charge à la surface de leurs protéines cibles. Seconde, stabilité des peptides :les peptides peuvent potentiellement être coupés par des enzymes (protéases) en plus petits, fragments inutiles ou même des acides aminés simples.
Le laboratoire de Christian Heinis à l'EPFL a maintenant relevé ces deux défis en développant le nouveau format de peptide qu'ils appellent « peptides à double pontage ». Ce sont des chaînes de 10 à 15 acides aminés, dont quatre sont chimiquement reliés par deux ponts. Chaque pont relie une paire de deux acides aminés de cystéine, quatre au total.
Parce que les quatre cystéines peuvent être placées dans de nombreuses configurations différentes le long de la séquence d'acides aminés, la stratégie de double pont a permis aux chercheurs de générer un nombre extrêmement important d'architectures peptidiques structurellement diverses. Ils ont encore élargi la diversité en utilisant différents réactifs chimiques qui ont augmenté le nombre de ponts. Les scientifiques ont également découvert que les quatre cystéines pouvaient être pontées par deux lieurs de trois manières différentes, donnant lieu à trois architectures différentes à partir de chaque séquence peptidique unique.
En utilisant cette stratégie, les chercheurs ont produit une énorme diversité de structures peptidiques, tous avec des structures "squelettiques" différentes. En outre, les chimistes ont systématiquement modifié les acides aminés entre les cystéines et généré des bibliothèques de milliards de peptides à double pontage différents. Après avoir passé au crible les bibliothèques, les chercheurs ont pu isoler des liants de haute affinité à des cibles protéiques importantes. L'une de ces cibles était la kallikréine, une protéine plasmatique associée à un angio-œdème héréditaire, un trouble rare de l'enflure. Un autre était l'interleukine-17, une protéine cytokine impliquée dans plusieurs troubles inflammatoires tels que la polyarthrite rhumatoïde et le psoriasis. En utilisant l'approche à double pont pour ces deux cibles protéiques, les scientifiques ont développé des peptides capables de les lier efficacement à des concentrations nanomolaires. Dans le cas de la kallicréine, les peptides pourraient le lier pendant plus d'une heure avant de se dissocier.
La stabilité était également une caractéristique très attrayante du nouveau format de peptide. Les peptides à double pont sont à peine dégradés par les protéases dans le sang, ce qui est un grand avantage car il empêche les peptides d'être éliminés trop rapidement, prolongeant ainsi leurs effets thérapeutiques. Sur la base des résultats, Le laboratoire de Heinis applique maintenant le format peptidique à de nombreuses autres maladies cibles. Ils ont déjà développé de nouveaux, bibliothèques de peptides à double pont encore plus grandes et les ont criblées contre une gamme de cibles pertinentes pour la maladie. L'un de ces peptides fait déjà l'objet d'une évaluation préclinique.