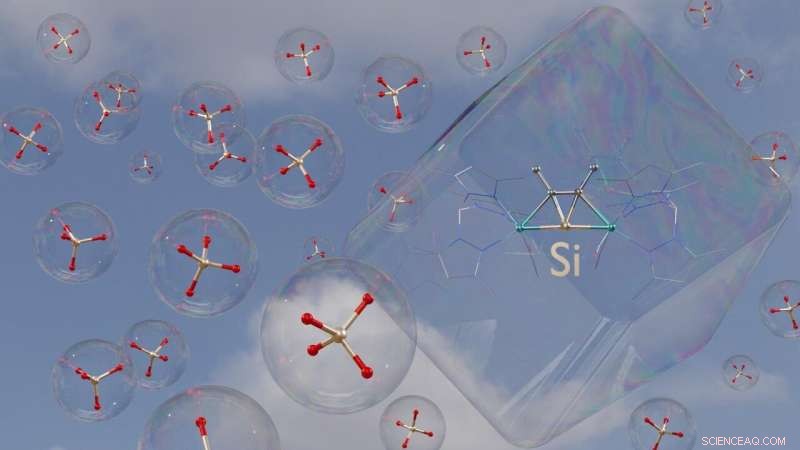
Représentation 3D d'une des nouvelles molécules. Des ions de silicate dans un arrangement tétraédrique peuvent être vus dans les bulles de savon sphériques à des fins de comparaison. Crédit :Jens Rump / Université de Bonn
Des chimistes de l'Université de Bonn (Allemagne) ont synthétisé des composés extrêmement inhabituels. Leur bloc de construction central est un atome de silicium. Différent de d'habitude, cependant, est l'arrangement des quatre partenaires de liaison de l'atome, qui ne sont pas en forme de tétraèdre autour d'elle, mais plat comme un trapèze. Cette disposition est généralement énergétiquement extrêmement défavorable, pourtant les molécules sont très stables. Leurs propriétés sont complètement inconnues jusqu'à présent; les chercheurs veulent maintenant les explorer. Les résultats seront publiés dans le Journal de l'American Chemical Society , mais sont déjà disponibles en ligne.
Comme son carbone relatif, le silicium forme généralement quatre liaisons avec d'autres atomes. Quand c'est le cas, le résultat est généralement un tétraèdre. L'atome de silicium est situé au centre, ses partenaires de liaison (appelés ligands) aux coins tétraédriques. Cette disposition est la plus favorable énergétiquement. Il survient donc quasi automatiquement, tout comme une bulle de savon est généralement sphérique.
Des chercheurs dirigés par le professeur Alexander C. Filippou de l'Institut de chimie inorganique de l'Université de Bonn ont maintenant construit des molécules contenant du silicium qui sont aussi inhabituelles qu'une bulle de savon en forme de cube. Dans ces, les quatre ligands ne forment pas un tétraèdre, mais un carré déformé, un trapèze. Ils se trouvent dans un plan avec le silicium. "Malgré cela, les composés sont si stables qu'ils peuvent être mis dans des bouteilles et stockés pendant des semaines sans aucun problème, " explique le Dr Priyabrata Ghana, un ancien doctorant qui a depuis déménagé à l'Université RWTH d'Aix-la-Chapelle.
Les exotiques moléculaires sont exceptionnellement stables
Les chercheurs eux-mêmes ont été surpris par cette stabilité inhabituelle. Ils ont découvert la raison en modélisant les molécules sur ordinateur. Les ligands forment également des liaisons entre eux. Dans le processus, ils forment un cadre solide. Cela semble être si fort qu'il empêche complètement l'arrangement trapézoïdal de "se casser" dans un tétraèdre. "Nos calculs informatiques indiquent qu'il n'y a pas de structure pour les molécules qui serait plus énergétiquement favorable que la forme trapézoïdale plane, " souligne Jens Rump, doctorant à l'Institut de chimie inorganique.
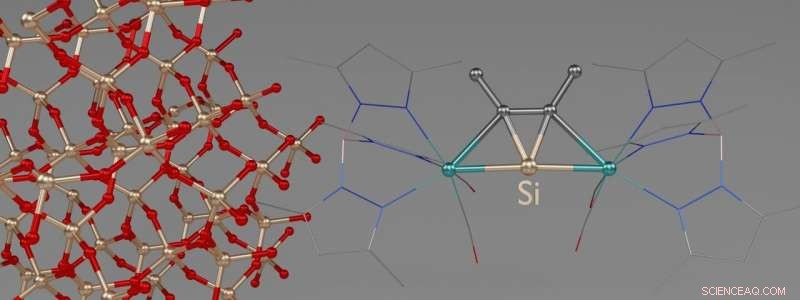
Représentation 3D de l'une des nouvelles molécules. La moitié gauche de l'image montre une section de la structure cristalline d'un cristal de quartz avec des atomes de silicium entourés de tétraèdres. Crédit :Jens Rump / Université de Bonn
Les chercheurs ont fait pousser des cristaux de ces substances, puis les ont fait exploser avec des rayons X. La lumière des rayons X est diffusée par les atomes et change de direction. Ces écarts peuvent donc être utilisés pour calculer la structure spatiale des molécules dans le cristal. Avec des mesures spectroscopiques, cette méthode a confirmé que les ligands et le silicium sont bien dans le même plan dans les nouvelles molécules.
Bien que la synthèse des composés exotiques doive être effectuée sous gaz inerte, c'est par ailleurs relativement simple. Produire les matières premières, d'autre part, est complexe ; l'un d'eux a été synthétisé pour la première fois il y a un peu plus de dix ans et a déjà été à l'origine de la synthèse de plusieurs nouvelles classes de composés du silicium.
L'influence de la structure inhabituelle sur les propriétés du silicium, un élément important pour l'industrie électronique, n'est pas du tout clair pour le moment. À tout prix, Pendant longtemps, il a été considéré comme totalement impossible de produire de tels composés.