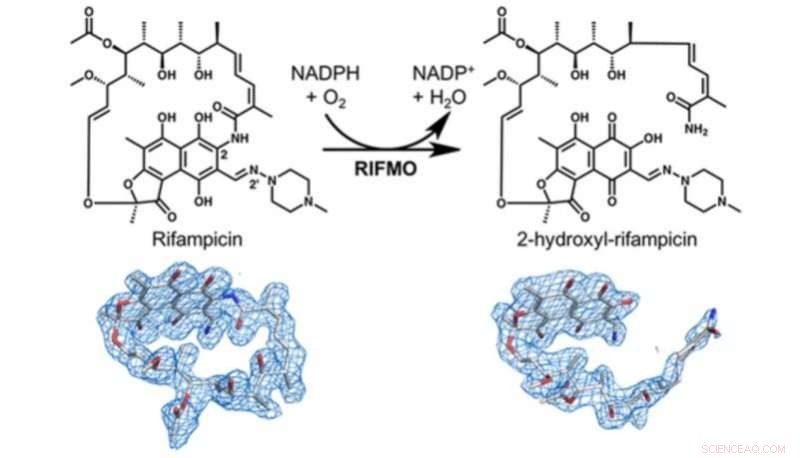
Cette figure montre la preuve structurelle de la façon dont la rifampicine monooxgénase (RIFMO) inactive la rifampicine, conversion de la rifampicine cyclique en forme linéaire 2-hydroxyl-rifampicine. Crédit :Pablo Sobrado
Une équipe de recherche de Virginia Tech en collaboration avec des chercheurs de l'Université du Missouri-Columbia a découvert un mécanisme responsable de la résistance aux antibiotiques chez les bactéries qui causent la tuberculose et la lèpre.
La connaissance de ce mécanisme permettra à terme aux chercheurs de concevoir des médicaments plus efficaces pour traiter ces maladies.
Ces résultats ont été récemment publiés dans la revue Biochimie .
Rifampicine, un antibiotique populaire utilisé pour traiter la tuberculose et la lèpre, fonctionne en empêchant les bactéries de se développer. Cependant, le médicament devient moins efficace que Mycobacterium tuberculosis, les bactéries qui causent la tuberculose, et Mycobacterium leprae, les bactéries qui causent la lèpre, développer une résistance.
Cette résistance se produit en partie parce que les bactéries ont une certaine enzyme, appelée rifampicine monooxygénase, qui inactive la rifampicine en modifiant chimiquement sa structure.
Pablo Sobrado, professeur de biochimie au Collège d'agriculture et des sciences de la vie, et son équipe ont travaillé en collaboration avec le biochimiste John Tanner et l'associé postdoctoral Li-Kai Liu à l'Université du Missouri-Columbia pour découvrir que la rifampicine monooxygénase convertit la rifampicine d'une forme cyclique ou cyclique en une forme linéaire. Une fois que la rifampicine est sous cette forme linéaire, il n'est plus efficace pour tuer les bactéries.

Pablo Sobrado, professeur de biochimie au Collège d'agriculture et des sciences de la vie, et son étudiant diplômé, Heba Abdelwahab, étudier la résistance aux antibiotiques de la rifampicine causée par l'enzyme bactérienne rifampicine monooxygénase. Crédit :Virginia Tech
"Cette découverte est passionnante car elle est primordiale pour la conception de médicaments, " dit Sobrado, une filiale du Fralin Life Science Institute et du Virginia Tech Center for Drug Discovery. "Cela peut aider les chercheurs à concevoir de nouveaux analogues de la rifampicine qui sont plus efficaces car ils ne sont pas susceptibles d'être inactivés par cette enzyme bactérienne."
Les membres de l'équipe de Sobrado qui ont aidé à identifier le mécanisme comprennent Yumin Dai, actuellement associé de recherche principal au département de chimie du Collège des sciences, et l'étudiante diplômée en visite Heba Abdelwahab de Damiette, Egypte. Dans une étude précédente, Abdelwahab a décrit la structure atomique et moléculaire de la rifampicine monooxygénase en utilisant la cristallographie aux rayons X.
Dans cette étude récente, financé par une subvention de la National Science Foundation, L'équipe de Sobrado a utilisé la cristallographie aux rayons X, analyse RMN, et la spectroscopie de masse pour identifier la modification chimique de la rifampicine par la rifampicine monoxygénase. Avant ce constat, les chercheurs savaient que la rifampicine monoxygénase inactivait la rifampicine, mais ils ne comprenaient pas comment.
« La résistance aux antibiotiques est un problème évolutif qui impacte fortement la santé publique, ", a déclaré Abdelwahab. "Nos études ont montré comment cette enzyme désactive la rifampicine. Nous avons maintenant un plan pour inhiber cette enzyme. »
Dai, qui a mené cette recherche en tant qu'associé postdoctoral dans le laboratoire de Sobrado, ajoutée, « sur la base de la compréhension de ce mécanisme, la prochaine étape de la recherche pourrait se concentrer sur le développement de divers inhibiteurs enzymatiques afin de traiter la résistance aux antibiotiques, tels que les imitateurs de rifampicine structurellement simplifiés, qui agiraient comme des inhibiteurs compétitifs."
Les chercheurs en médicaments peuvent également commencer à concevoir des formes améliorées de rifampicine via une modification synthétique qui ne sont pas susceptibles d'être modifiées chimiquement par l'enzyme bactérienne qui la cible.
Bien que traitable, la tuberculose et la lèpre sont des maladies qui menacent les enfants, les personnes âgées, personnes dans les pays en développement sans accès à des soins de santé adéquats, et d'autres dont le système immunitaire est affaibli. Selon les Centers for Disease Control and Prevention, plus de 10 millions de personnes dans le monde étaient atteintes de tuberculose en 2016. Les taux et la prévalence de la lèpre sont bien inférieurs; au niveau mondial, moins d'un cas sur 10, 000 personnes sont recensées chaque année, et 96 pour cent de ces cas proviennent de pays en développement.