Les hélicases sont des enzymes qui déroulent l'ADN et l'ARN. Ils jouent un rôle central dans la vie cellulaire, sont impliqués dans un certain nombre de cancers et d'infections et, hélas, extrêmement difficiles à cibler avec des médicaments.
Aujourd’hui, de nouvelles recherches fournissent une plate-forme puissante pour concevoir des inhibiteurs covalents adaptés aux hélicases cibles. L'article, publié dans le Journal of the American Chemical Society , décrit comment les chercheurs ont utilisé cette nouvelle plateforme innovante pour concevoir des molécules ciblant les hélicases impliquées dans le COVID et certains cancers.
"Les données structurelles et biochimiques à haute résolution ne suffisent pas à elles seules pour trouver des sites médicamentables dans des enzymes conformationnellement dynamiques telles que les hélicases", déclare Tarun Kapoor de l'Université Rockefeller. "Notre approche peut identifier ces sites et également fournir des points de départ chimiques pour développer des médicaments ciblant les hélicases."
Machines moléculaires complexes qui traversent les brins d'ADN et d'ARN, les hélicases doivent relancer le processus de démêlage qui prépare l'information génétique pour des processus tels que la réplication ou la transcription. Mais lorsque les hélicases deviennent dévoyées, elles peuvent favoriser la croissance de certains cancers. Dans le même temps, les hélicases jouent également un rôle crucial dans la réplication virale et la prolifération bactérienne. Il s’ensuit que différents médicaments ciblant ces enzymes pourraient traiter certains cancers, ou arrêter les infections dans leur élan.
"Les hélicases sont des cibles très prisées à l'heure actuelle", déclare l'auteur principal Jared Ramsey, étudiant diplômé du laboratoire Kapoor. "Les médicaments qui inhibent les hélicases présentent un grand intérêt pour la communauté scientifique et pourraient être exploités en tant que traitements nouveaux et efficaces."
Les inhibiteurs de l’hélicase sont cependant difficiles à trouver. En testant des milliers de petites molécules, les sociétés pharmaceutiques ont parfois découvert des méthodes permettant d'arrêter une hélicase ou une autre, mais ces événements se sont révélés rares. "La même chose était vraie dans notre laboratoire", explique Ramsey. "Nous n'avons pas pu identifier les inhibiteurs de l'hélicase en utilisant des approches classiques telles que le criblage à haut débit."
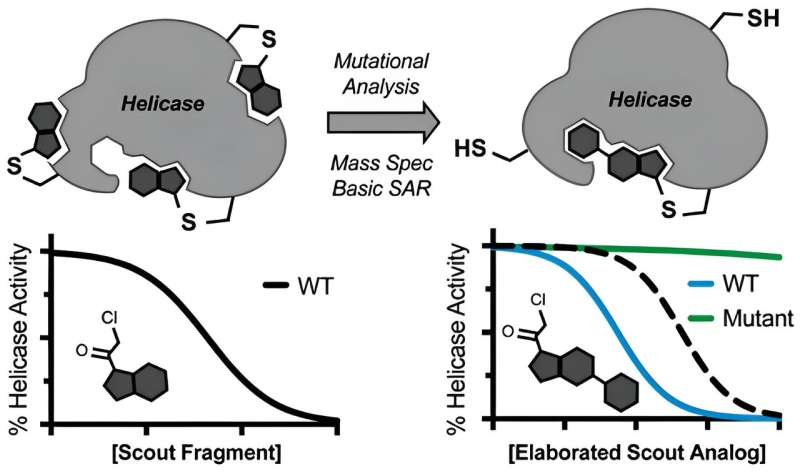
Ramsey, Kapoor et leurs collègues se sont demandés si de petites molécules électrophiles pouvaient être utilisées pour détecter les points faibles d'une hélicase, poussant discrètement l'enzyme à la recherche de sites de liaison potentiels sensibles aux médicaments.
Au cœur de cette idée se trouve le concept de covalence, dans lequel les candidats inhibiteurs se lient de manière irréversible à la cible hélicase, évitant ainsi les complications liées à la nature dynamique et fluide de ces enzymes. À cette fin, l’équipe a sélectionné deux molécules inoffensives et a dirigé les fragments dits éclaireurs vers une hélicase du SRAS-CoV-2.
Une fois qu’ils ont trouvé des sites de liaison probables sur l’hélicase, ils ont promu les éclaireurs au rang de soldats. "Nous avons simplement dû prendre une molécule électrophile peu élaborée, identifier où elle se lie avec la spectrométrie de masse, puis utiliser la chimie médicinale pour la modifier et en examiner quelques versions afin d'obtenir un inhibiteur puissant et spécifique", explique Ramsey.
L’équipe a également démontré que les fragments de reconnaissance pouvaient être réglés pour arrêter deux hélicases spécifiques, BLM et WRN, impliquées respectivement dans le syndrome de Bloom et le syndrome de Werner, ainsi que dans un certain nombre de cancers. Même si les résultats publiés ne devraient pas se traduire immédiatement par des médicaments qui traitent le COVID ou le cancer, ils constituent un point de départ précieux pour les développeurs de médicaments souhaitant créer des cibles hélicase sur mesure.
"Nos résultats montrent comment la plateforme que nous avons développée pourrait accélérer les travaux dans d'autres laboratoires", explique Ramsey. "Nous adoptons une approche scientifique fondamentale, et c'est ainsi que de nombreuses découvertes utiles sont découvertes. Cela pose un problème difficile et nous donne un point de départ solide."
Plus d'informations : Jared R. Ramsey et al, Utilisation d'une approche basée sur les « fragments de reconnaissance » axée sur la fonction pour développer des inhibiteurs allostériques covalents de mécanoenzymes hélicases conformationnellement dynamiques, Journal of the American Chemical Society (2023). DOI : 10.1021/jacs.3c10581
Fourni par l'Université Rockefeller