Quiconque souhaite produire des médicaments, des plastiques ou des engrais à l’aide de méthodes conventionnelles a besoin de chaleur pour les réactions chimiques, mais ce n’est pas le cas pour la photochimie, où la lumière fournit l’énergie. Le processus permettant d'obtenir le produit souhaité nécessite également souvent moins d'étapes intermédiaires.
Des chercheurs de l'Université de Bâle vont désormais plus loin et démontrent comment l'efficacité énergétique des réactions photochimiques peut être multipliée par 10. Des applications plus durables et plus rentables sont désormais très proches.
Les réactions chimiques industrielles se produisent généralement en plusieurs étapes dans divers produits intermédiaires. La photochimie permet des raccourcis, ce qui signifie que moins d'étapes intermédiaires sont nécessaires. La photochimie permet également de travailler avec des substances moins dangereuses qu'en chimie conventionnelle, car la lumière produit une réaction dans des substances qui réagissent mal à la chaleur. Cependant, jusqu'à présent, il n'y a pas eu beaucoup d'applications industrielles pour la photochimie, en partie parce que la fourniture d'énergie par la lumière est souvent inefficace ou crée des sous-produits indésirables.
Le groupe de recherche dirigé par le professeur Oliver Wenger de l'Université de Bâle décrit désormais un principe fondamental qui a un impact étonnamment fort sur l'efficacité énergétique de la photochimie et peut augmenter la vitesse des réactions photochimiques. Leurs résultats sont publiés dans Nature Chemistry .
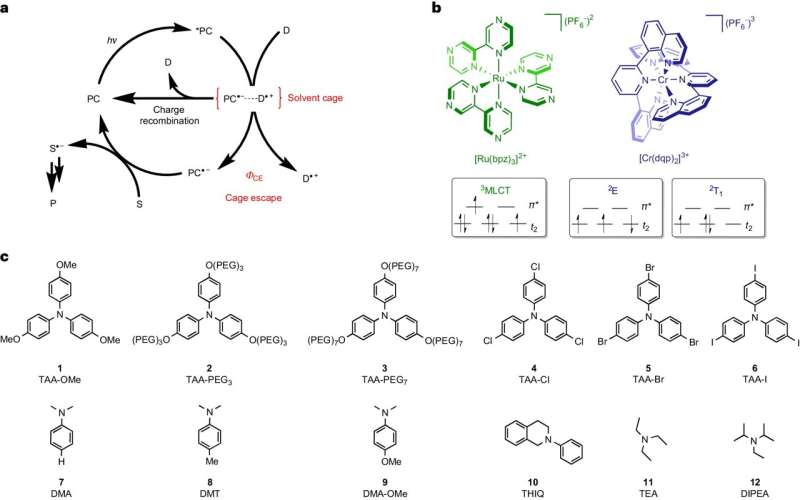
Dans le cas de ce type de réaction, les molécules de départ sont en solution liquide. S’ils reçoivent de l’énergie sous forme de lumière, ils peuvent échanger des électrons entre eux et former des radicaux. Ces molécules extrêmement réactives se présentent toujours par paires et restent entourées d'un solvant, qui enferme les paires de radicaux comme une sorte de cage.
Pour que les radicaux puissent continuer à réagir aux produits cibles souhaités, ils doivent « sortir » de cette cage et trouver un partenaire de réaction à l'extérieur de celle-ci. L'équipe entourant Wenger et son postdoc Dr Cui Wang ont identifié ce processus d'éclatement comme une étape décisive qui limite l'efficacité énergétique et la vitesse des réactions photochimiques.
Tant que les radicaux restent par paires dans la cage du solvant, ils peuvent réagir spontanément les uns avec les autres pour redevenir les matières premières. Cette réaction inverse gaspille de l'énergie car elle utilise uniquement la lumière déjà absorbée pour revenir au point de départ.
L'équipe de Bâle a pu ralentir cette réaction inverse et ainsi donner aux radicaux plus de temps pour quitter la cage. Plus la réaction inverse indésirable durait, plus les radicaux étaient capables de se libérer et plus les produits cibles souhaités se développaient de manière économe en énergie et plus rapidement.
Wang, qui occupe désormais le poste de professeur adjoint à l'université d'Osnabrück, a utilisé dans son étude deux colorants particuliers, qui absorbent tous deux la lumière et stockent son énergie pendant une courte période avant de l'utiliser pour former des paires de radicaux. Cependant, l'un des deux colorants examinés était capable de stocker beaucoup plus d'énergie que l'autre et de la transférer aux radicaux.
Grâce à l’énergie supplémentaire, les radicaux ont pu quitter la cage du solvant jusqu’à dix fois plus efficacement. Les produits visés sont ainsi fabriqués avec une efficacité énergétique jusqu'à dix fois supérieure. "Ce lien direct entre les radicaux sortant de la cage du solvant et la formation efficace des produits cibles est étonnamment clair", a déclaré Wang.
La principale découverte est que certains colorants peuvent libérer plus de radicaux que d’autres en fonction de la quantité de lumière absorbée. "Le choix du colorant peut être utilisé pour augmenter l'efficacité énergétique des réactions photochimiques", a déclaré Wenger. À son tour, il affirme que l'efficacité énergétique est également un critère décisif pour l'utilisation industrielle de la photochimie.
Plus d'informations : L'évasion de la cage régit les taux de réaction photorédox et les rendements quantiques, Nature Chemistry (2024). DOI : 10.1038/s41557-024-01482-4
Fourni par l'Université de Bâle