La pandémie de COVID-19 a fait des millions de morts. Malgré un effort de recherche collaboratif sans précédent qui a conduit à la production de vaccins et de thérapies efficaces en un temps record, une compréhension complète de la structure et du cycle de vie du coronavirus connu sous le nom de SRAS-CoV-2 fait toujours défaut.
Les scientifiques ont utilisé les biolabs et l'instrument SPB/SFX du XFEL européen pour étudier la principale protéase, ou Mpro, du virus afin de comprendre comment il se protège des dommages oxydatifs. Les résultats ajoutent des connaissances clés à notre compréhension du fonctionnement du SRAS-CoV-2 et du domaine de la biologie virale.
L'article est publié dans la revue Nature Communications .
Entre janvier 2020 et mars 2023, plus de six millions de personnes sont mortes des suites de la maladie respiratoire COVID-19 et plusieurs centaines de millions ont été infectées. La maladie est causée par le SRAS-CoV-2, un coronavirus.
"Les coronavirus sont un groupe de virus à ARN qui provoquent des maladies chez les mammifères et les oiseaux", explique Richard Bean, scientifique européen du XFEL. "Cependant, malgré leur importance significative pour la santé humaine mondiale, il reste encore beaucoup à apprendre sur la structure et la fonction des coronavirus en général et du SRAS-CoV-2 en particulier."
En réponse à l’apparition de la pandémie, des scientifiques et des organisations scientifiques du monde entier ont déployé des efforts pour étudier la structure, la dynamique et la fonction du SRAS-CoV-2 à la recherche de vaccins et de thérapies. En raison de son rôle central dans le cycle de réplication du virus, la protéase principale, une enzyme qui libère les fragments de virus nouvellement fabriqués les uns des autres, est rapidement devenue une cible clé des médicaments antiviraux.
La protéase principale, ou Mpro, est particulièrement intéressante pour le développement de médicaments car elle joue un rôle central dans la réplication virale, mais aussi parce qu'elle est assez différente de toutes les protéines humaines. Cela permet aux thérapies de cibler spécifiquement le virus tout en minimisant les effets secondaires susceptibles de nuire aux patients. Des programmes antérieurs de découverte de médicaments ciblant d'autres virus ont réussi à utiliser des inhibiteurs de protéase virale, ce qui rend plus probable un résultat positif dans le cas du SRAS-CoV-2.
"Bien que le pic de la pandémie de COVID-19 soit passé, l'étude du virus SARS-CoV-2 reste encore très utile", déclare Thomas Lane du Centre pour la science des lasers à électrons libres (CFEL) à Hambourg. "Le COVID continue de présenter une menace sanitaire importante dans le monde entier. Compte tenu de la persistance de ce virus et de l'émergence possible de futurs coronavirus pathogènes, il est impératif que nous développions une compréhension plus approfondie de Mpro et de son rôle dans la fonction virale."
Dans une expérience récente réalisée avec l'instrument SPB/SFX du XFEL européen, Lane et ses collègues ont utilisé le faisceau de rayons X intense pour étudier Mpro. Plusieurs études structurelles antérieures portant sur Mpro ont mis en évidence un certain nombre de particularités.
"Premièrement, la protéine forme une structure 3D appelée dimère lorsqu'elle est trouvée à des concentrations élevées", explique Robin Schubert, scientifique européen du XFEL, qui a participé à l'expérience. "Cette habitude structurelle semble influencer directement son activité, mais nous ne savons pas précisément pourquoi cela est important pour le virus." Parallèlement à des informations clés sur la structure 3D, des études récentes ont également fait allusion à l'importance des niveaux d'oxygène cellulaire pour l'activité des protéases.
"Il semble que même une légère exposition à l'oxygène diminue l'activité de Mpro", explique Patrick Reinke, également du CFEL. En effet, en présence de suffisamment d’oxygène, le renouvellement cesse complètement. Mais ce processus est réversible :si l'oxygène est éliminé, l'enzyme se réactive, ce qui suggère que le système a développé des mécanismes de protection pour survivre dans un environnement oxydatif.
"Il a été démontré que le stress oxydatif régule la fonction d'autres virus, comme le VIH", ajoute Reinke. "Il a été suggéré que les changements structurels de la protéase lui permettent d'échapper aux dommages oxydatifs dans les environnements riches en oxygène. Cependant, nous ne sommes toujours pas sûrs de l'impact de ces mécanismes de protection sur la forme physique du virus."
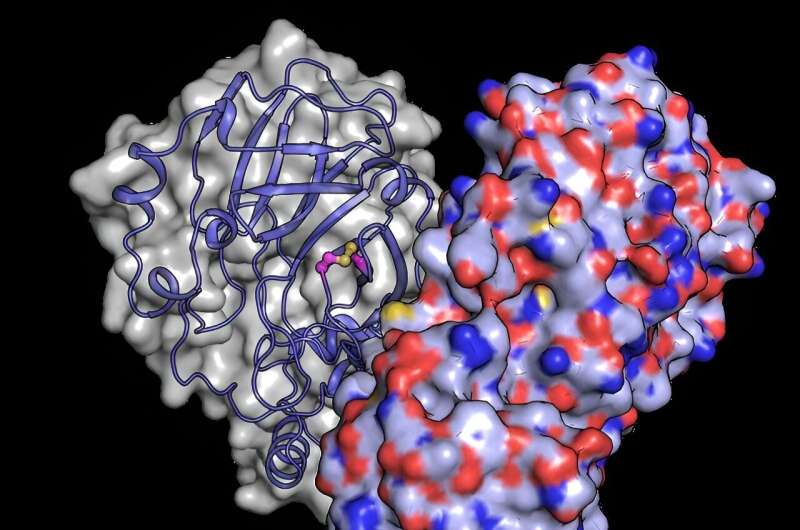
Pour mieux comprendre comment les changements structurels protègent la protéine des dommages causés par l'oxygène, l'équipe a utilisé le puissant faisceau de rayons X du XFEL européen pour révéler la structure de Mpro après son exposition à l'oxygène. Ils ont découvert un réarrangement structurel de Mpro dans lequel une liaison se forme entre deux résidus cystéine :le site actif cystéine C145 et une cystéine distale C117.
Pour ce faire, l’équipe a produit de grandes quantités de Mpro pendant plusieurs mois dans les biolabs du XFEL européen et l’a transformé en microcristaux, dont certains ont été cultivés en présence d’oxygène. Enfin, les microcristaux ont été envoyés voler devant le faisceau européen XFEL de l'instrument SPB/SFX à l'aide d'un jet de liquide.
De tels petits cristaux sont impossibles à étudier à l’aide de sources lumineuses traditionnelles, car la quantité de rayonnement nécessaire pour générer suffisamment de données à partir des cristaux les détruirait. Les impulsions de rayons X produites par le XFEL européen sont cependant si puissantes et si courtes qu'elles peuvent être utilisées pour capturer une image du cristal de protéine avant qu'il n'ait le temps de se désintégrer.
"Nos résultats montrent que la cystéine, le site actif qui dirige la chimie de l'enzyme, peut se cacher sournoisement des dommages oxydatifs", explique Schubert. En règle générale, l'oxydation peut endommager les cystéines de manière irréversible.
Lors de l'oxydation, cependant, Mpro protège sa cystéine la plus importante en formant ce que l'on appelle une « liaison disulfure », qui l'enterre au cœur de la structure protéique. Ensuite, si elle est replacée dans un environnement sûr et pauvre en oxygène, la liaison disulfure peut se rompre, révélant la cystéine active, qui reprend sa fonction d'origine.
"Les expériences réalisées au XFEL européen révèlent une image de la protéine dans son état disulfure caché, confirmant son existence et révélant son fonctionnement", explique Schubert.
"Mpro présente un ensemble inhabituellement riche de modifications d'oxydation, et notre expérience ajoute un élément clé à cette histoire", explique Lane. Les scientifiques sont enthousiasmés par ce qu’indiquent leurs données et par les prochaines étapes. "Mpro est un pilier de la biologie des coronavirus et la première cible des thérapies à petites molécules anti-COVID-19.
"Il a été démontré que la fonction de l'enzyme est régulée à la fois par la dimérisation et l'oxydation, et il est clair que ces mécanismes de régulation sont biophysiquement corrélés. Alors que nos structures fournissent un aperçu mécaniste de ces propriétés de Mpro, nous devons maintenant comprendre comment la régulation basée sur le stress oxydatif ou La concentration en protéines a un impact sur la forme physique du virus. Cela fournira un aperçu plus approfondi de la biologie virale et, espérons-le, ouvrira de nouvelles opportunités pour perturber cette biologie avec des médicaments qui préservent la vie. »
Plus d'informations : Patrick Y. A. Reinke et al, SARS-CoV-2 Mpro répond à l'oxydation en formant des liaisons disulfure et NOS/SONOS, Nature Communications (2024). DOI :10.1038/s41467-024-48109-3
Informations sur le journal : Communications naturelles
Fourni par XFEL européen