Crédit :Angewandte Chemie (2022). DOI :10.1002/ange.202117849
La β-N-acétylglucosamine liée à O (O-GlcNAcylation), une importante modification post-traductionnelle (PTM) des protéines, est impliquée dans diverses fonctions biologiques.
La modification réversible de l'O-GlcNAc confère des fonctions protéiques on-off au cours des processus biologiques. Les aberrations de la O-GlcNAcylation sont étroitement associées à de nombreuses maladies métaboliques ainsi qu'à l'invasion et à la métastase de plusieurs tumeurs.
Récemment, une équipe de recherche dirigée par le professeur Ye Mingliang et le professeur Qin Hongqiang du Dalian Institute of Chemical Physics (DICP) de l'Académie chinoise des sciences (CAS), en collaboration avec le professeur Huang Wei du Shanghai Institute of Materia Medica de CAS, a développé une nouvelle stratégie de marquage chimioenzymatique réversible des glycopeptides O-GlcNAc, qui a permis une analyse approfondie de la protéine O-GlcNAcylation.
Leurs découvertes ont été publiées dans Angewandte Chemie le 14 mars.
Pour permettre l'analyse de l'O-GlcNAcylation à l'échelle du protéome, il est essentiel d'enrichir sélectivement les glycopeptides à partir des digestions d'échantillons complexes.
De nombreux chercheurs ont recherché l'enrichissement en peptides O-GlcNAcylés avant analyse par chromatographie liquide avec spectrométrie de masse en tandem (LC-MS/MS). Cependant, la plupart des approches souffrent d'une faible affinité de liaison ou d'étiquettes volumineuses, qui interfèrent avec l'enrichissement et l'identification des peptides O-GlcNAcylés.
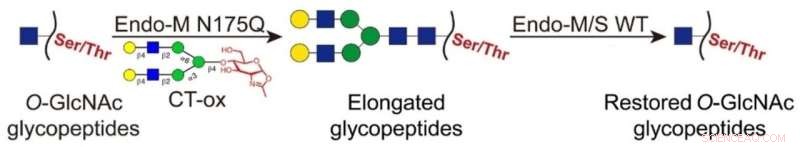
Dans cette stratégie nouvellement développée, les fragments O-GlcNAc ont été ligaturés avec de longs N-glycanes à l'aide d'un mutant Endo-M, ce qui a permis l'enrichissement des glycopeptides marqués par chromatographie liquide à interaction hydrophile (HILIC). Ensuite, les glycanes attachés sur les glycopeptides enrichis ont été éliminés par Endo-M/S de type sauvage pour restaurer le fragment O-GlcNAc.
Par rapport au marquage chimioenzymatique classique, cette approche a permis l'identification sans étiquette et a éliminé l'interférence des étiquettes volumineuses dans la détection des glycopeptides.
De plus, en utilisant cette méthode, les chercheurs ont identifié 657 glycosites O-GlcNAc potentiels à partir de seulement 0,4 mg de protéines nucléaires de cellules HeLa, ce qui n'a été nécessaire qu'à 1/10 des échantillons de protéines pour une analyse O-GlcNAcylation comparable, indiquant la haute sensibilité de ce méthode.
Au total, ils ont identifié 1 414 glycosites à partir de seulement 1,1 mg d'échantillons de protéines, et 45 % d'entre eux n'ont pas été inclus dans l'O-GlcNAcAltas de tous les échantillons humains au cours des 35 dernières années, ce qui a amélioré la couverture d'analyse de la protéine O-GlcNAcylation.
"Cette stratégie d'enrichissement sans étiquette représente une voie unique pour l'analyse de l'O-GlcNAcylation à l'échelle du protéome et favorise les études de mécanismes", a déclaré le professeur Ye. Les mécanismes moléculaires de la maladie d'Alzheimer