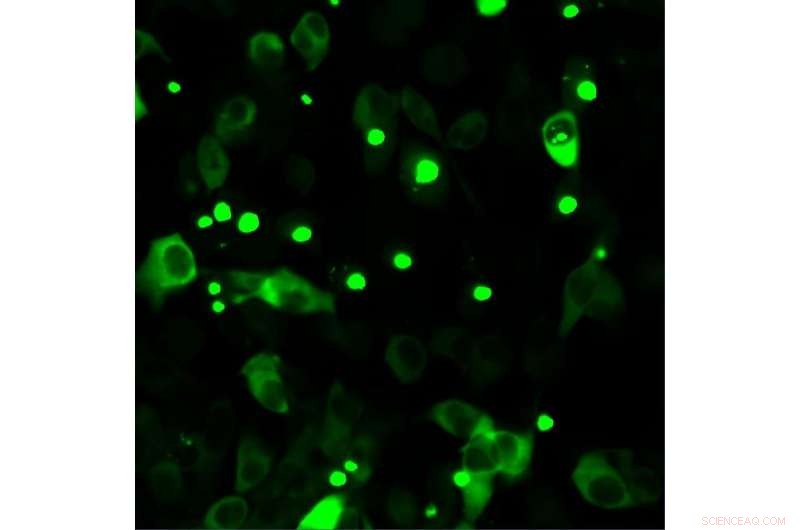
Cellules humaines produisant de la huntingtine mutante marquée par fluorescence. La huntingtine mutée a tendance à s'accumuler, ce qui est pathologique et visible sous forme de points. Crédit :Université de Brême
La chorée de Huntington est une maladie héréditaire qui entraîne des troubles cognitifs et moteurs et la mort. Des scientifiques de l'Université de Brême ont travaillé avec des partenaires internationaux pour élucider le mécanisme par lequel la protéine huntingtine mutée peut être tenue à distance.
"Nous avons découvert un mécanisme par lequel les aides au repliement des protéines de l'organisme maintiennent la protéine huntingtine mutée à distance", explique Janine Kirstein, responsable du projet et professeure à l'Université de Brême. Les aides au repliement des protéines permettent aux protéines de prendre et de maintenir leur structure correcte pour remplir leurs fonctions à multiples facettes. Les chercheurs connaissaient déjà trois des aides, mais ce qu'ils ne savaient pas encore, c'était à quoi ressemblait la liaison avec la protéine huntingtine mutée, laquelle des trois aides au repliement pouvait reconnaître la protéine mutée et à quoi ressemblait sa liaison.
"Nous avons maintenant pu l'identifier grâce à la méthode de spectrométrie de masse par réticulation", explique le biochimiste. Cette méthode permet de déterminer avec précision les interactions protéiques. Cependant, il restait encore un long chemin à parcourir en termes de compréhension du lien. "Ce n'est que grâce à la modélisation que nous avons pu mieux comprendre l'interaction entre les aides au repliement des protéines et la huntingtine mutante."
Une recherche réussie grâce à une interdisciplinarité éprouvée
Le succès de ces nouvelles connaissances réside dans la pratique de l'interdisciplinarité :« Si nous avons pu obtenir nos résultats avec une telle précision, c'est principalement grâce à l'excellente coopération entre les facultés de biologie/chimie et de génie de la production de l'université de Brême », déclare Kirstein. "En biochimie, nous avions besoin de chercheurs pour notre projet qui pourraient nous accompagner dans notre travail expérimental en laboratoire avec des modèles assistés par ordinateur".
Son étudiante diplômée Yasmin Richter a trouvé l'expertise nécessaire en sciences de l'ingénieur auprès de son ancienne camarade de maîtrise en biochimie et biologie moléculaire, Isabell Grothaus. Elle fait son doctorat dans le groupe de travail dirigé par le Dr Susan Köppen et le professeur Lucio Colombi Ciacchi. C'est ainsi que les deux jeunes chercheurs ont développé une coopération entre les deux facultés. "Les ingénieurs ont simulé pour nous la liaison entre les aides au repliement des protéines et la protéine huntingtine mutée sur un ordinateur, et nous avons ensuite pu valider expérimentalement la modélisation dans notre laboratoire avec des protéines purifiées et dans des cultures cellulaires", explique Kirstein.
Un autre obstacle était la structure jusqu'alors inconnue de la protéine huntingtine mutée. Les partenaires de coopération Martin Kulke et Josh Vermaas de l'Université d'État du Michigan aux États-Unis ont pu aider ici, postulant une structure qui permettrait d'effectuer la modélisation sur ordinateur. Un autre partenaire de coopération important était Fan Liu avec les expériences de spectrométrie de masse menées à l'Institut de recherche Leibniz pour la pharmacologie moléculaire à Berlin. C'est également là que Kirstein a dirigé un groupe de travail jusqu'en 2019 avant sa nomination à l'Université de Brême.
S'appuyer sur les résultats de la recherche
"Grâce à ce travail, nous avons réussi à comprendre le mécanisme par lequel un assistant au repliement des protéines détecte sélectivement une protéine mutée associée à la maladie et la rend inoffensive. Cela seul n'est pas suffisant pour un usage thérapeutique", déclare Kirstein. "Mais vous pouvez vous appuyer sur ces résultats et développer des stratégies pour induire ou stabiliser spécifiquement ces aides au pliage spécifiques au corps afin de supprimer la toxicité de la huntingtine mutée."
La recherche a été publiée dans Nature Communications . Les protéines membranaires humaines atteignent l'équilibre évolutif