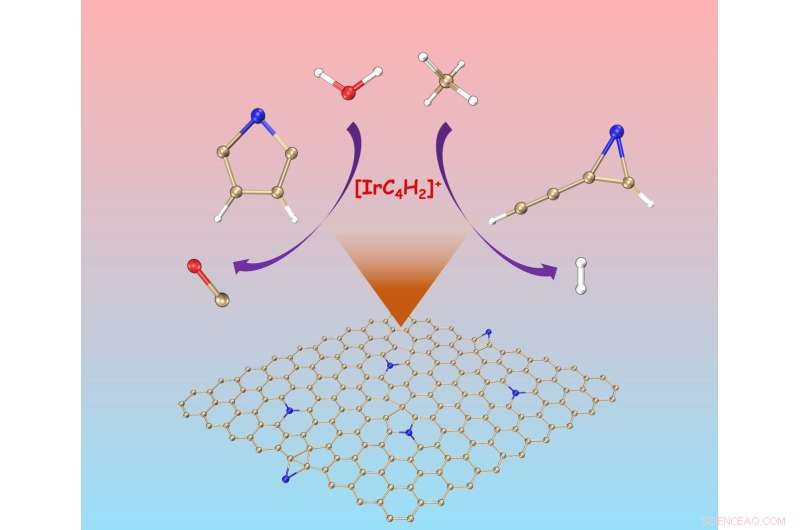
Un des deux isomères de [IrC4 H2 ] + active uniquement le méthane tandis que l'autre réagit uniquement avec l'eau pour produire du CO. Crédit :Science China Press
Cette étude a été dirigée par le professeur Shaodong Zhou (Collège de génie chimique et biologique, Université du Zhejiang) et le professeur Xiao-Nan Wu (Département de chimie, Université Fudan). Les expériences ont été réalisées en utilisant un spectromètre de masse à piège à ions équipé d'un ion de vaporisation-expansion supersonique laser combiné à des calculs de chimie quantique.
Fait intéressant, dans les conditions employées, deux isomères de [IrC4 H2 ] + coexistent avec différentes réactivités, l'une d'entre elles n'active que le méthane tandis que l'autre ne réagit qu'avec l'eau pour produire du CO. La réactivité vis-à-vis du méthane dépend principalement de l'orientation orbitale, tandis que la π-aromaticité du complexe réactionnel est importante pour la conversion de l'eau.
"En raison de la structure de surface complexe et de la composition des catalyseurs, il est très important de corréler la structure électronique du centre actif avec ses réactivités. En tant que modèle idéal pour étudier le mécanisme de réaction à un niveau strictement moléculaire, la réaction en phase gazeuse peut être effectuée dans des conditions excluant les interférences de l'environnement extérieur et, étant bien reproductible. Combiné avec le calcul chimique quantique, cela peut nous aider à comprendre en profondeur le mécanisme de réaction et à mettre en œuvre la conception rationnelle de catalyseurs à haute performance », a déclaré Zhou.
Quelques implications émergent donc pour la conception d'un catalyseur Ir pour le reformage à la vapeur du méthane :1) plus de trous d'électrons sont attendus sur les orbites d (probablement induits par la polarisation locale) pour le H3 initial activation C-H ; 2) dans l'interaction du centre Ir avec le CH4 /H2 O molécule, une augmentation de l'aromaticité locale défavorise une transformation ultérieure, tandis qu'une augmentation de l'anti-aromaticité locale est indicative d'une activation supplémentaire de la liaison; l'augmentation de l'aromaticité et de l'anti-aromaticité peut être plus évidente pour l'eau.
La recherche a été publiée dans Science China Chemistry . Comprendre l'aromaticité en catalyse pour ouvrir de nouvelles opportunités