Une découverte par une équipe de chercheurs pourrait rendre plus faisable la transformation du dioxyde de carbone en carburants. Crédit :Steve Suib
Un nouveau catalyseur décompose le dioxyde de carbone en produits chimiques utiles plus rapidement, moins cher, et plus efficacement que la méthode standard, rapporte une équipe de chercheurs dans le numéro de cette semaine de PNAS . La découverte pourrait permettre de transformer économiquement le dioxyde de carbone en carburants.
Le dioxyde de carbone est un produit stable, gaz abondant. En fait c'est un peu trop abondant, et le dioxyde de carbone supplémentaire dans l'atmosphère change le climat de la planète. Sachant cela, de nombreux chimistes travaillent sur des moyens efficaces de transformer le dioxyde de carbone en d'autres produits utiles. Mais la stabilité du dioxyde de carbone rend cela difficile. Il est difficile d'obtenir la molécule, heureux tout seul, réagir avec autre chose.
La meilleure technique existante pour briser électrochimiquement le dioxyde de carbone en morceaux qui réagiront chimiquement utilise un catalyseur en platine. Mais le platine est un rare, métal cher.
Maintenant, une équipe de chercheurs dirigée par Yongtao Meng, un ancien étudiant diplômé de l'UConn dans le laboratoire du directeur de l'Institute for Materials Science Steve Suib et maintenant chercheur à l'Université de Stanford, a trouvé une meilleure façon. Ils ont créé une cellule électrochimique remplie d'un poreux, catalyseur mousseux fait de nickel et de fer. Les deux métaux sont bon marché et abondants. Lorsque le gaz carbonique pénètre dans la cellule électrochimique, et une tension est appliquée, le catalyseur aide le dioxyde de carbone (un atome de carbone avec deux oxygènes) à briser l'oxygène pour former du monoxyde de carbone (un atome de carbone avec un oxygène.) Le monoxyde de carbone est très réactif et un précurseur utile pour fabriquer de nombreux types de produits chimiques, y compris les plastiques et les carburants comme l'essence.
Non seulement le nouveau catalyseur nickel-fer fonctionne bien; il est en fait plus efficace que le coûteux processus de platine qu'il pourrait remplacer. La cellule électrochimique utilisant le catalyseur nickel-fer obtient une efficacité de presque 100 %.
« C'est presque du jamais vu. Généralement, dans un bon système, vous obtiendrez une efficacité de 90 à 95 %, mais ce n'est peut-être pas stable, peut ne pas fonctionner à la même basse tension ou peut ne pas être bon marché, " dit Suib. Ce processus a tout cela.
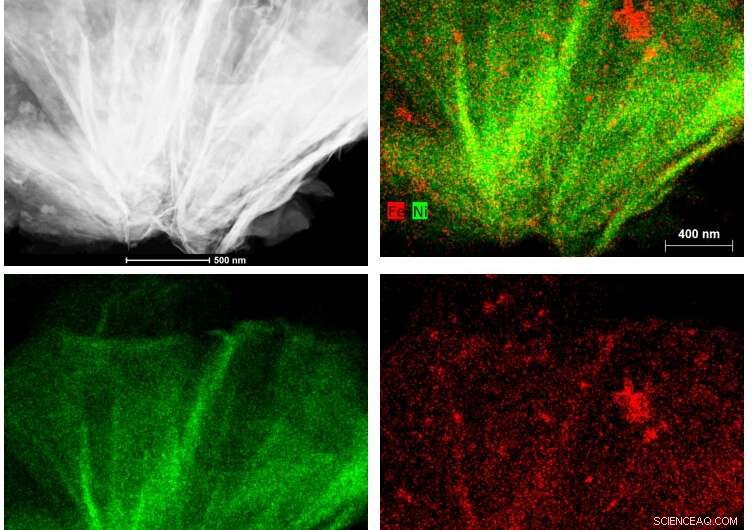
Le laboratoire de Suib a utilisé la microscopie électronique à transmission à balayage pour cartographier les coupes transversales du nouveau catalyseur nickel-fer, révélant sa structure interne. Techniquement, c'est un carbonate d'hydroxyde de fer nickel, avec une structure poreuse qui permet au gaz de dioxyde de carbone de s'écouler à travers elle. Les travaux de microscopie de Suib ont montré que le catalyseur est resté intact et ne s'est pas dégradé à l'usage.
La prochaine étape du processus consiste à voir s'il peut être étendu, fabriqué en vrac, et testé dans des situations industrielles telles que des centrales électriques qui produisent de grandes quantités de dioxyde de carbone en tant que déchet.