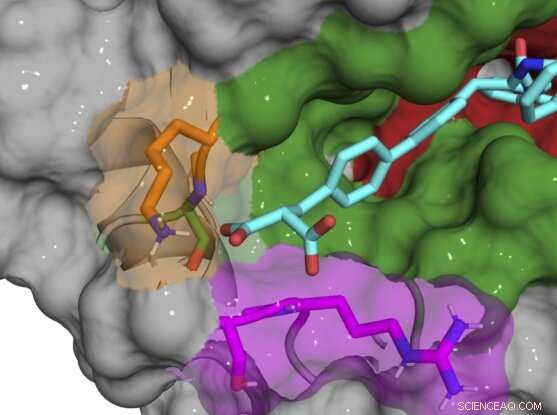
Structure co-cristalline aux rayons X du composé B52 (cyan) liant et inhibant la protéine cyclophiline D. Crédit :Aziz Rangwala
La cyclosporine est l'un des médicaments immunosuppresseurs les plus courants et les plus efficaces utilisés pour traiter les maladies chroniques comme l'arthrite et le psoriasis, mais elle comporte un risque d'effets secondaires graves. Les scientifiques pensent que cela peut être dû au fait que le médicament cible largement les cyclophilines, une famille de 17 protéines régulatrices qui jouent différents rôles dans la promotion de la santé cellulaire. Bien que chaque sous-type de cyclophiline ait un rôle unique, de nombreux médicaments immunosuppresseurs actuels ciblent toute la famille, ce qui signifie que des voies inconnues importantes peuvent être accidentellement désactivées ou autrement modifiées.
Le problème est compliqué par le fait que le site actif où les molécules se lient est presque identique sur les 17 cyclophilines, ce qui rend difficile pour les fabricants de médicaments de cibler des sous-types spécifiques. Dans un article publié aujourd'hui dans Nature Chemical Biology , scientifiques du laboratoire du membre principal du Broad Institute David Liu, qui est également directeur du Merkin Institute of Transformative Technologies in Healthcare à Broad, en collaboration avec les laboratoires de Markus Seeliger à SUNY Stony Brook et du membre de l'Institut Vamsi Mootha au Massachusetts General L'hôpital a proposé une nouvelle solution.
Plutôt que de cibler le site actif des protéines de cyclophiline, les chercheurs du laboratoire de Liu décrivent un processus qui trouve des composés qui se lient au "site exo", une petite poche à côté du site actif dont la taille et la forme varient selon les différentes cyclophilines. En utilisant des protéines isolées dans un tube à essai, l'équipe a découvert plusieurs composés qui se lient et inhibent exclusivement la cyclophiline D (CypD), une protéine impliquée dans l'ouverture et la fermeture des pores mitochondriaux. Ils ont également appliqué des principes similaires pour découvrir des inhibiteurs uniques et sélectifs de la cyclophiline E (CypE). Les auteurs affirment que leur étude jette les bases permettant aux scientifiques de développer d'autres inhibiteurs sélectifs de sous-types de la cyclophiline, dont certains pourraient être utiles comme outils pour la biologie ou comme pistes de développement thérapeutique.
"C'est un nouveau mode de reliure qui tire parti d'une poche que les gens n'ont pas encore complètement explorée", a déclaré l'auteur principal Alex Peterson, maintenant stagiaire postdoctoral au Scripps Research Institute, qui a dirigé le projet en tant qu'étudiant diplômé dans le laboratoire de Liu. . "C'est une sorte de modèle sur la façon dont les gens peuvent concevoir des inhibiteurs sélectifs de la cyclophiline à l'avenir."
Exploitation des nouvelles et anciennes technologies
CypD régule le pore de transition de perméabilité mitochondriale (mPTP), de petits pores situés sur la surface interne des mitochondries (célèbres comme la centrale électrique de la cellule). Lorsque CypD détecte un stress oxydatif ou des niveaux élevés de calcium, il se précipite pour ouvrir le mPTP, permettant à l'eau et à d'autres ions d'entrer et de sortir des mitochondries.
Cette ouverture des vannes mitochondriales peut devenir un problème avec des maladies telles que les lésions d'ischémie-reperfusion, le diabète, les troubles neurodégénératifs, les maladies du foie, etc. Étant donné que ces conditions peuvent provoquer des niveaux anormalement élevés de stress oxydatif, CypD maintient les pores mitochondriaux ouverts plus longtemps que d'habitude, provoquant un dysfonctionnement mitochondrial, une rupture et la mort cellulaire. On pense que les médicaments qui ralentissent et inhibent la réaction de CypD à un stress oxydatif élevé pourraient être utilisés pour traiter une multitude de maladies.
Pour retrouver des composés qui se lient exclusivement à CypD, l'équipe s'est tournée vers des bibliothèques de petites molécules codées par ADN, une technologie développée il y a plus de vingt ans comme l'un des premiers projets dans le nouveau laboratoire de Liu. Les chercheurs peuvent utiliser les bibliothèques, qui sont remplies de centaines de milliers de composés synthétiques attachés à des codes-barres d'ADN uniques, pour rechercher des molécules qui se lient aux protéines souhaitées. En mélangeant des protéines CypD isolées et une collection de 256 000 composés uniques codés par l'ADN dans un tube à essai, l'équipe a identifié des centaines de composés prometteurs.
La plupart des composés initiaux se liaient toujours dans et autour du site actif, inhibant plusieurs sous-types de cyclophiline, de sorte que l'équipe a progressivement apporté de petites modifications chimiques à leurs composés pour les rendre uniques à CypD. Une fois qu'ils ont découvert que le site exo était la clé du développement d'inhibiteurs spécifiques au sous-type, ils ont pu concevoir une paire de composés qui inhibent puissamment CypD tout en affectant de manière minimale les autres cyclophilines. Les structures co-cristallines aux rayons X de la protéine CypD et des inhibiteurs au cours du développement ont donné à l'équipe un aperçu des coulisses de l'emplacement précis où leurs molécules se lient.
Les chercheurs ont ensuite traité des mitochondries isolées avec leurs deux composés phares et ont observé qu'ils étaient efficaces pour ralentir l'ouverture des pores mitochondriaux par CypD. Les images miroir de leurs composés, qui n'inhibent pas la CypD, n'ont pas montré d'activité dans les mitochondries. Pour prouver que leur succès n'était pas un incident isolé, ils ont de nouveau répété la stratégie pour CypE, une cyclophiline responsable de la régulation du traitement de l'ARNm. Une fois de plus, ils ont développé un composé qui le ciblait exclusivement et a laissé les 16 cyclophilines restantes sans phase.
L'équipe espère que leurs découvertes pourront finalement aider les biologistes chimiques et les fabricants de médicaments à développer des médicaments ciblant la cyclophiline meilleurs et plus spécifiques. Ils ont même donné une longueur d'avance aux futurs scientifiques :étant donné que les composés ciblant la CypD ont du mal à pénétrer seuls dans les cellules humaines, l'équipe les a modifiés en ajoutant des dérivés d'esters qui contournent efficacement la membrane plasmique et délivrent dans les mitochondries.
"Le travail de notre équipe nous a finalement permis de vaincre ce problème de longue date :comment inhiber sélectivement un seul sous-type de cyclophiline sur 17 ?" a déclaré Liu, qui est également chercheur à l'Institut médical Howard Hughes. "A l'avenir, les molécules issues de l'utilisation de notre stratégie s'avéreront, je l'espère, utiles à la fois pour la science fondamentale et potentiellement pour la thérapeutique." Une nouvelle stratégie de synthèse accélère l'identification de versions plus simples d'un produit naturel