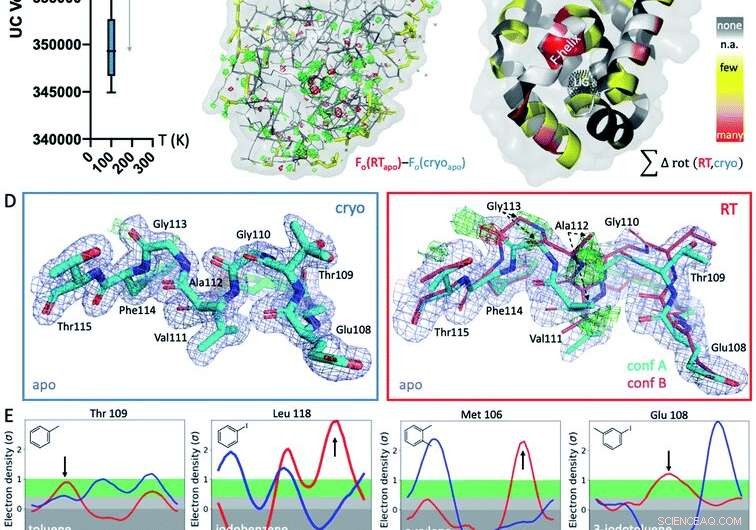
Fig. 1 Réponses structurelles globales et locales à la température. (A) Globalement, les structures à températures cryogéniques (cryo; tracé bleu) sont plus variables et plus compactes que leurs équivalents à température ambiante (RT; tracé rouge), comme le montrent les volumes moyens de cellules unitaires (UC) sur 9 structures appariées collectées aux deux températures. (B) La carte Fo - Fo isomorphe de la structure apo collectée au cryo par rapport à la RT montre des différences dans la densité électronique (maille verte, densité électronique de différence positive; maille rouge, densité électronique de différence négative) qui indiquent des effets de température idiosyncratiques, en particulier autour du site de liaison du ligand dans le lobe inférieur, indiqué par le maillage en pointillé noir dans le panneau C (étiqueté LIG). (C) L'apparition de différences de rotamère dépendantes de la température dans les 9 structures est projetée sur les résidus respectifs dans la structure apo T4L ; coloré par la sensibilité à la température de chaque résidu sur les 9 paires de structures :jaune pour quelques structures, orange pour plusieurs structures, et rouge pour la plupart des structures montrant des différences de température du résidu; les taches blanches sont Gly et Ala qui n'ont pas d'angles Chi; et les taches grises ne montrent aucun changement de rotamère avec la température. (D) Localement, Les données RT de la cavité apo L99A révèlent une conformation alternative en hélice F (conf. B) dans les cartes de densité électronique de différence Fo − Fc (maille verte et rouge pour la densité positive et négative, respectivement; seule la conformation cyan A a été incluse dans le raffinement) qui n'est pas visible au cryo ; Carte 2mFo − DFc affichée sous forme de maillage bleu ; l'épaisseur du bâton représente l'occupation relative. (E) Les 8 complexes de ligand montrent un changement d'orientation préférée en réponse à la température plutôt qu'en raison de la liaison du ligand pour au moins 1 résidu rotamère dans l'hélice F près du site de liaison du ligand. Graphiques Ringer pour les résidus sélectionnés, avec des différences de rotamère à RT (rouge) par rapport à cryo (bleu) indiquées par des flèches. Crédit :DOI :10.1039/D1SC02751D
Environ 95% de toutes les structures cristallines obtenues pour diverses protéines et déposées dans des bases de données publiques sont capturées à l'aide de la technologie cryogénique. Cette technologie nécessite des conditions gelées. Les scientifiques du St. Jude Children's Research Hospital ont comparé les structures cryogéniques avec celles observées à température ambiante. Les résultats, publié aujourd'hui dans Sciences chimiques , indiquer que le gel peut introduire des erreurs, provoquer certaines conformations (formes) à manquer et conduire à des inexactitudes dans les modèles de calcul.
Les structures protéiques sont essentielles au processus de développement de médicaments car elles fournissent une carte de la façon dont les médicaments ciblés doivent être conçus.
"Nous devons repenser la façon dont nous collectons, analyser et utiliser des informations structurelles lorsque nous nous efforçons de découvrir des molécules bioactives, " a déclaré l'auteur correspondant Marcus Fischer, Doctorat., Département de biologie chimique et thérapeutique de St. Jude. "Vous pouvez voir la température comme un bouton expérimental que nous pouvons tourner pour explorer les conformations cachées des protéines."
La température fait toute la différence
Les chercheurs ont montré que la congélation déforme les conformations que prennent les protéines, introduisant souvent des erreurs dans les structures. L'équipe a également découvert que certaines conformations se produisant dans des conditions de température ambiante peuvent passer inaperçues si l'on ne regarde que les résultats des techniques cryogéniques.
Les chercheurs ont mené une évaluation systématique des structures cryogéniques, en commençant par la cavité du lysozyme L99A T4. Cette protéine est considérée comme une « bête de somme » en biologie structurale pour comprendre la stabilité des protéines, rigidité et thermodynamique de liaison de ligand. Le passage à la température ambiante a révélé de nouveaux changements structurels qui ont été manqués pendant des décennies.
L'équipe a testé quatre classes supplémentaires de protéines. Les résultats sont restés vrais quel que soit le type de protéine évalué.
"Quand tu sors en hiver et que tu as froid, tu te compresses et tu te replies sur toi-même, et au soleil quand tu as chaud tu t'allonges. Les protéines font de même, " a déclaré Fischer.
Éviter les erreurs
Les méthodes de calcul sont des algorithmes que les chercheurs utilisent pour faire des prédictions ou évaluer les données obtenues à partir de leurs expériences. Les résultats indiquent que lorsque ces méthodes sont construites sur des données de structures cryogéniques, des erreurs peuvent être introduites qui peuvent entacher les résultats futurs.
Les techniques cryogéniques ont longtemps été privilégiées car elles facilitent l'obtention des structures. Obtenir des structures à température ambiante est plus fastidieux. Bien qu'il existe des moyens d'atténuer ces problèmes, des facteurs tels que l'exhaustivité des données et les dommages causés par les rayonnements sont des obstacles supplémentaires pour de nombreux chercheurs dans l'obtention de structures à température ambiante.
Bien que la détection d'une forme de protéine cachée soit informative, montrant l'impact de la nouvelle forme sur les protocoles de découverte de médicaments manquait toujours.
"Nous avons vu que la protéine a adopté un état pour interagir avec les ligands, et que les informations manquantes peuvent aider à améliorer la précision du dépistage virtuel des médicaments et des simulations d'interaction protéine-ligand, " a déclaré le co-premier auteur Shanshan Bradford, Doctorat., Département de biologie chimique et thérapeutique de St. Jude.
Les chercheurs soulignent que lorsqu'on ne considère que les structures cryogéniques, il n'y a aucun moyen de savoir s'il y a des erreurs, mais cette comparaison avec des structures à température ambiante peut aider à clarifier les informations et potentiellement révéler des informations supplémentaires qui seraient autrement manquées.