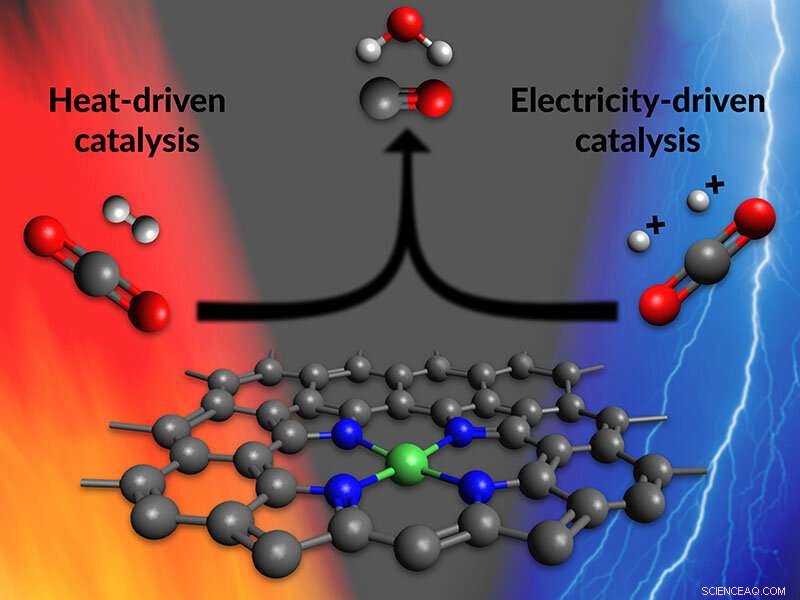
Cette illustration montre l'un des sites actifs d'un nouveau catalyseur qui accélère la première étape de fabrication de carburants et de produits chimiques utiles à partir de dioxyde de carbone. Les sites actifs sont constitués d'atomes de nickel (vert) liés à des atomes d'azote (bleu) et dispersés dans un matériau carboné (gris). Les chercheurs du SLAC et de Stanford ont découvert que ce catalyseur, appelé NiPACN, fonctionne dans des réactions entraînées par la chaleur ou l'électricité - une étape importante vers l'unification de la compréhension des réactions catalytiques dans ces deux environnements réactionnels très différents. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Pratiquement toute la production de produits chimiques et de carburant repose sur des catalyseurs, qui accélèrent les réactions chimiques sans être consommés dans le processus. La plupart de ces réactions ont lieu dans d'énormes cuves de réacteur et peuvent nécessiter des températures et des pressions élevées.
Les scientifiques ont travaillé sur des moyens alternatifs pour conduire ces réactions avec de l'électricité, plutôt que de la chaleur. Cela pourrait potentiellement permettre à bon marché, efficace, fabrication distribuée alimentée par des sources d'électricité renouvelables.
Mais les chercheurs qui se spécialisent dans ces deux approches – chaleur versus électricité – ont tendance à travailler de manière indépendante, développer différents types de catalyseurs adaptés à leurs environnements réactionnels spécifiques.
Une nouvelle ligne de recherche vise à changer cela. Des scientifiques de l'Université de Stanford et du SLAC National Accelerator Laboratory du ministère de l'Énergie ont annoncé aujourd'hui qu'ils avaient fabriqué un nouveau catalyseur qui fonctionne avec de la chaleur ou de l'électricité. A base d'atomes de nickel, le catalyseur accélère une réaction pour transformer le dioxyde de carbone en monoxyde de carbone - la première étape dans la fabrication de carburants et de produits chimiques utiles à partir de CO
Les résultats représentent une étape importante vers l'unification de la compréhension des réactions catalytiques dans ces deux conditions très différentes avec des forces motrices distinctes en jeu, dit Thomas Jaramillo, professeur au SLAC et à Stanford et directeur du SUNCAT Institute for Interface Science and Catalysis, où la recherche a eu lieu.
"C'est une rareté dans notre domaine, " a-t-il dit. " Le fait que nous puissions le réunir dans un même cadre pour regarder le même matériau est ce qui rend ce travail spécial, et cela ouvre une toute nouvelle voie pour examiner les catalyseurs d'une manière beaucoup plus large."
Les résultats expliquent également comment le nouveau catalyseur entraîne cette réaction clé plus rapidement lorsqu'il est utilisé dans un réacteur électrochimique, l'équipe de recherche a déclaré. Leur rapport est paru dans l'édition imprimée de Angewandte Chemie cette semaine.
Vers un avenir de la chimie durable
Trouver des moyens de transformer le CO
A la recherche de nouvelles directions, SUNCAT a formé une équipe de doctorants. étudiants impliquant trois groupes de recherche du département de génie chimique de Stanford :Sindhu Nathan du groupe du professeur Stacey Bent, dont les recherches portent sur les réactions catalytiques thermiques, et David Koshy, qui est co-dirigé par Jaramillo et le professeur Zhenan Bao et s'est concentré sur les réactions électrochimiques.
Le travail de Nathan visait à comprendre les réactions catalytiques entraînées par la chaleur à un niveau fondamental, niveau atomique.
« Les réactions provoquées par la chaleur sont ce qui est couramment utilisé dans l'industrie maintenant, " dit-elle. " Et pour certaines réactions, un processus thermique serait difficile à mettre en œuvre car il peut nécessiter des températures et des pressions très élevées pour que la réaction souhaitée se produise. »
Conduire des réactions avec l'électricité pourrait rendre certaines transformations plus efficaces, Koshy a dit, "parce que vous n'avez pas à chauffer les choses, et vous pouvez également rendre les réacteurs et autres composants plus petits, moins cher et plus modulaire, en plus c'est un bon moyen de tirer parti des ressources renouvelables."
Les scientifiques qui étudient ces deux types de réactions travaillent en parallèle et interagissent rarement, ils n'ont donc pas beaucoup d'occasions d'acquérir des connaissances les uns des autres qui pourraient les aider à concevoir des catalyseurs plus efficaces.
Mais si les deux camps pouvaient travailler sur le même catalyseur, cela établirait une base pour unifier leur compréhension des mécanismes de réaction dans les deux environnements, dit Jaramillo. "Nous avions des raisons théoriques de penser que le même catalyseur fonctionnerait dans les deux ensembles de conditions de réaction, " il a dit, "mais cette idée n'avait pas été testée."
Une nouvelle voie pour la découverte de catalyseurs
Pour leurs expériences, l'équipe a choisi un catalyseur Koshy récemment synthétisé appelé NiPACN. Les parties actives du catalyseur - les endroits où il attrape les molécules qui passent, les fait réagir et libère les produits - constitués d'atomes de nickel individuels liés à des atomes d'azote qui sont dispersés dans le matériau carboné. Les recherches de Koshy avaient déjà déterminé que NiPACN peut entraîner certaines réactions électrochimiques avec une grande efficacité. Pourrait-il faire la même chose dans des conditions thermiques ?
Pour répondre à cette question, l'équipe a amené le catalyseur en poudre à la source lumineuse de rayonnement synchrotron de Stanford (SSRL) du SLAC. Ils ont travaillé avec le scientifique distingué Simon Bare pour développer un minuscule réacteur où le catalyseur pourrait accélérer une réaction entre l'hydrogène et le dioxyde de carbone à des températures et pressions élevées. La configuration leur a permis de projeter des rayons X dans la réaction à travers une fenêtre et de regarder la réaction se dérouler.
En particulier, ils voulaient voir si les conditions difficiles à l'intérieur du réacteur modifiaient le catalyseur car elles facilitaient la réaction entre l'hydrogène et le CO
"Les gens pourraient dire, comment savez-vous que la structure atomique n'a pas changé, ce qui en fait un catalyseur légèrement différent de celui que nous avions précédemment testé dans des réactions électrochimiques?", A déclaré Koshy. "Nous devions montrer que les centres de réaction du nickel ont toujours la même apparence lorsque la réaction est terminée."
C'est exactement ce qu'ils ont trouvé lorsqu'ils ont examiné le catalyseur dans les moindres détails avant et après la réaction aux rayons X et à la microscopie électronique à transmission.
Aller de l'avant, l'équipe de recherche a écrit, des études comme celle-ci seront essentielles pour unifier l'étude des phénomènes catalytiques dans les environnements réactionnels, ce qui renforcera à terme les efforts pour découvrir de nouveaux catalyseurs pour transformer les industries du carburant et de la chimie.